Cинтез пиримидиновых нуклеотидов de novo
Структура
пиримидинового кольца проще, и путь
биосинтеза пиримидинов короче, чем у
пуринов. Амидный азот глутамина и диоксид
углерода обеспечивает атомы 2 и 3 кольца
пиримидина после преобразования их в
карбамоилфосфат (рис 8.16). Другие четыре
атома кольца происходят из аспартата.
Так же как и в случае с пуриновыми
нуклеотидами, углеводная часть
поставляется ФРПФ.
Карбамоилфосфат.
Образование пиримидиновых нуклеотидов
начинается с синтеза карбамоил фосфата,
который протекает в цитозоле тканей,
способных к образованию пиримидинов
(наиболее высокая активность синтеза
в селезенке, тимусе, ЖКТ и яичках).
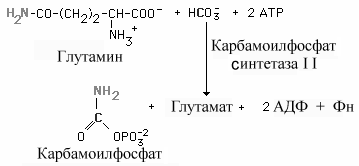 Карбамоил
Карбамоил
фосфат, как упоминалось в главе об обмене
аминокислот, используется также в
синтезе мочевины.
Его образование
в клетках катализируется двумя разными
карбамоилфосфат синтетазами — IиII.Основные различия
между ними приведены в таблице 8.3.
|
Таблица
1111
|
||
|
Карбамоил |
Карбамоил |
|
|
Распределение |
Преимущественно
2222
|
Во |
|
Клеточная |
Митохондрия |
Цитозоль |
|
Метаболический |
Синтез
3333
|
Биосинтез |
|
Источник |
Ионы |
Аминогруппа
4444
|
Карбамоилфосфат
синтетаза II(КФСII)
предпочитает амид глутамина свободному
аммиаку и не требуетN-ацетилглутамата
в качестве косубстрата. У человекаnКФСII, аспартат-транскарбамоилазная, и
дигидрооротазная активности — это части
одного мультифункционального белка.
Образование
оротовой кислоты. Ключевая реакция.
Первая уникальная для биосинтеза
пиримидинов реакция – это реакция
конденсации карбамоилфосфата и аспартата
с образованием карбамоиласпартата,
катализируемая аспартаттранскарбамоилазой(реакция
2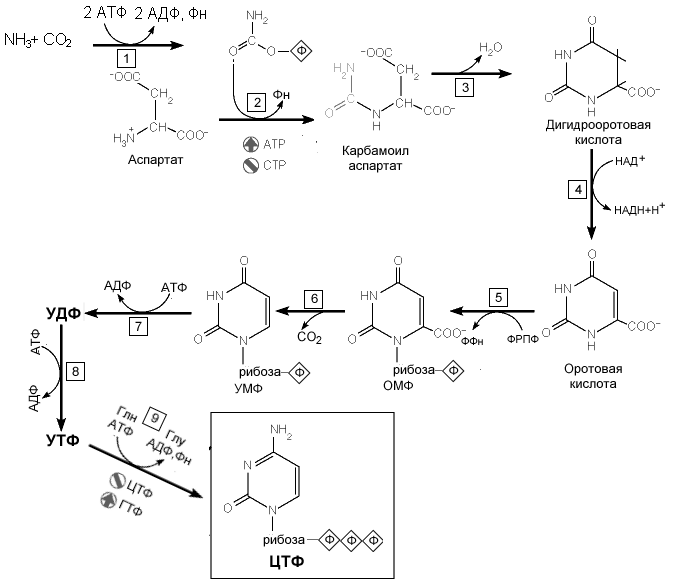 ).Затем дигидрооротаза катализирует
).Затем дигидрооротаза катализирует
отщепление Н2О с образованием
кольцевой структуры(реакция-3). Дегидрогеназа дигидрооротата,
используя НАД+в качестве
кофермента, формирует оротовую кислоту
— основного предшественника пиримидиновых
Рис. 8.17. Реакции синтеза пиримидиновых
нуклеотидов
оснований (реакция
4).
Образование
нуклеотидов.Образование мононуклеотида
происходит в реакции 5 путем присоединения
к оротовой кислоте остатка рибоза-5-фосфата.
Донором моносахарида служит ФРПФ. Первый
пиримидиновый мононуклеотид —
оротидинмонофосфат (ОМР). Эта реакция
катализируется оротат-фосфорибозилтрансферазой
— ферментом, аналогичным гипоксантин-гуанин—
фосфорибозилрансферазе и
аденин-фосфорибозил трансферазе, которые
участвуют в фосфорибозилировании
пуриновых колец при их реутилизации.
Первый главный
пиримидиновый рибонуклеотид — уридиловая
кислота (уридинмонофосфат, УМФ)
образуется путем декарбоксилирования
оротидилата (реакция б).
Дигидрооротатдегидрогеназа —
митохондриальный фермент. Все остальные
ферменты, участвующие в синтезе
пиримидиновdenovo,
локализуются в цитозоле. УМФ
подвергается двукратному фосфорилированию
и образующийся УТФ аминируется с
участием глутамина и АТФ и образованием
ЦТФ (реакция 9).
Регуляция синтеза
пиримидиновых нуклеотидов Ключевым
ферментом синтеза пиримидиновых
нуклеотидов у человека является
цитоплазматическая КФСII.
УТФ тормозит активность этого фермента,
конкурируя сATФ. ФРПФ
является активатором этого фермента.
Имеются и другие участки регуляции
(например,OMФ декарбоксилаза
ингибируется УМФ и ЦМФ). Однако при
нормальных условиях эти участки имеют
ограниченное значение. У бактерий
ключевым регуляторным ферментом
является аспартат транскарбомоилаза.
У них имеется только одна карбомоилфосфат
синтетаза, так как они не имеют митохондрий.
Карбомоилфосфат, таким образом, находится
на развилке метаболических путей,
которая ведет или к образованию
пиримидиновых нуклеотидов или к синтезу
аргинина.
Суммарная
сравнительная характеристика путей
синтеза пуриновых и пиримидиновых
нуклеотидов приводится в следующей
таблице.
|
Таблица |
||
|
Путь |
Путь |
|
|
Последовательность
5555
|
1.Образование 2.Сборка |
1.Сборка 2.Образование
6666
|
|
Ключевая |
Образование |
Образование |
|
Локализация |
Цитозоль |
Митохондрии |
|
Ферментгная |
Отдельные |
Отдельные |
|
Регуляция |
Торможение |
Торможение |
Белковый обмен общие сведения
В количественном отношении белки
образуют самую важную группу макромолекул.
В организме человека массой 70 кг
содержится примерно 10 кг белка, причем
большая его часть локализована в мышцах.
По сравнению с белками доля других
азотсодержащих веществ в организме
незначительна. Поэтому баланс азота в
организме определяется метаболизмом
белков, который регулируется несколькими
гормонами, прежде всего тестостероном
и кортизолом.
В организме взрослого человека метаболизм
азота в целом сбалансирован, т. е.
количества поступающего и выделяемого
белкового азота примерно равны. Если
выделяется только часть вновь поступающего
азота, баланс положителен. Это наблюдается,
например, при росте организма. Отрицательный
баланс встречается редко, главным
образом как следствие заболеваний.
Полученные с пищей белки подвергаются
полному гидролизу в желудочно-кишечном
тракте до аминокислот, которые всасываются
и кровотоком распределяются в организме.
8 из 20 белковых аминокислот не могут
синтезироваться в организме человека.
Эти незаменимые аминокислоты должны
поступать с пищей.
Через кишечник и в небольшом объеме
также через почки организм постоянно
теряет белок. В связи с этими неизбежными
потерями ежедневно необходимо получать
с пищей не менее 30 г белка. Эта минимальная
норма едва ли соблюдается в некоторых
странах, в то время как в индустриальных
странах содержание белка в пище чаще
всего значительно превышает норму.
Аминокислоты не запасаются в организме,
при избыточном поступлении аминокислот
в печени окисляется или используется
до 100 г аминокислот в сутки. Содержащийся
в них азот превращается в мочевину и в
этой форме выделяется с мочой, а углеродный
скелет используется в синтезе углеводов,
липидов или окисляется с образованием
АТФ.
Предполагается, что в организме взрослого
человека ежедневно разрушается до
аминокислот 300-400 г белка (протеолиз) В
тоже время примерно тоже самое количество
аминокислот включается во вновь
образованные молекулы белков (белковый
биосинтез). Высокий оборот белка в
организме необходим потому, что многие
белки относительно недолговечны: они
начинают обновляться спустя несколько
часов после синтеза, а биохимический
полупериод составляет 2-8 дней. Еще более
короткоживущими оказываются ключевые
ферменты промежуточного обмена. Они
обновляются спустя несколько часов
после синтеза. Это постоянное разрушение
и ресинтез позволяют клеткам быстро
приводить в соответствие с метаболическими
потребностями уровень и активность
наиболее важных ферментов. В
противоположность этому особенно
долговечны структурные белки, гистоны,
гемоглобин или компоненты цитоскелета.
Внутриклеточное разрушение белков
(протеолиз) происходит частично в
липосомах. Кроме того, в цитоплазме
имеются органеллы, так называемые
протеасомы, в которых разрушаются
неправильно свернутые или денатурированные
белки. Такие молекулы узнаются с помощью
специальных маркеров.
Нарушения синтеза и выведения мочевины
Гипераммониемия
– повышение концентрации аммиака в
крови. Интоксикация аммиаком лежит в
основе развития печеночной комы. Одной
из главных причин токсичности NH3
на молекулярном уровне является его
способность восстановительно аминировать
-кетоглутарат
в глутамат. В результате происходит
изъятие -кетоглутаровой
кислоты из ЦТК. Это может привести к
замедлению регенерации оксалоацетата
и, как следствие, к накоплению ацетил-КоА,
а через него к кетонемии и ацидозу, а
также к ослаблению потока протонов и
электронов в ЦТД и снижению продукции
АТФ.
Повышенная
концентрация аммиака в организме
приводит к активации глутаминсинтазы.
При этом количество глутамата, который
является нейромедиатором в ЦНС и
предшественнком ГАМК, истощается. Если
гиперамониемия не поддается лечению,
то развиваются тяжелые нарушения
психики.
Выделяют первичную
(врожденную) и вторичную (приобретенную)
гипераммониемию. К настоящему времени
описаны врожденные дефекты каждого
фермента, участвующего в синтезе
мочевины:
-
Гипреаммониемия
I-го
типа – дефект карбамоилфосфатсинтетазы
I. -
Гипреаммониемия
II-го
типа – дефект орнитинкарбамоилтрансферазы. -
Цитруллинемия –
отсутствует аргининосукцинатсинтаза. -
Аргининосукцинатацидурия
– дефект аргининосукцинатлиазы. -
Гипераргининемия
– дефект аргиназы. -
Полная потеря
активности хотя бы одного из ферментов
орнитинового цикла мочевинообразования
приводит в летальному исходу.
Вторичная
(приобретенную) гипераммониемия. При
заболеваниях печени (гепатиты) ее
функции, в том числе и мочевинообразование
снижается, что приводит к накоплению
аммиака в организме, так как только в
гепатоците присутствует весь набор
ферментов для синтеза мочевины. При
циррозе печени развиваются коллатерали
между портальной веной и нижней полой
веной, аммиак попадает в общий кровоток
и вызывает интоксикацию, проявляющуюся
поражением нервной системы. При усилении
катаболических процессов (обширные
травмы, опухоли, кахексия) – печень
перегружается поступающим аммиаком,
который не успевает превратится в
мочевину.
Азотемия
– повышенное накопление остаточного
азота в крови. Остаточный азот крови –
азот небелковых азотистых компонентов
в сыворотке крови (мочевины, креатинина,
креатина, мочевой кислоты, индикана,
аминокислот, аммиака). Так как 85% его
составляет азот мочевины, поэтому в
клинике исследуют не суммарный остаточный
азот, а уровень мочевины. Повышение
уровня мочевины в крови называется
уремия.
Уровень мочевины в крови зависит от
соотношения процессов ее синтеза и
выведения из организма. Выделяют
ретенционную и продукционную азотемию
(уремию).
Ретенционная
азотемия
наступает в результате недостаточного
выделения с мочой азотсодержащих
продуктов (в основном мочевины) при их
нормальном поступлении в кровяное
русло. Ретенционная азотемия, в свою
очередь, может быть почечной и внепочечной.
При почечной ретенционной азотемии
увеличение количества остаточного
азота в крови происходит за счет
ослабления экскреторной функции почек
(острая и хроническая почечная
недостаточность). Внепочечная ретенционная
азотемия может возникнуть в результате
тяжелой недостаточности кровообращения,
снижения артериального давления и
уменьшения почечного кровотока (при
профузных кровотечениях, травматическом
шоке, пороках сердца). Нередко внепочечная
азотемия является результатом наличия
препятствия оттоку мочи после ее
образования в почке (камни и опухоли
мочевого пузыря или мочевыводящих
путей).
Продукционная
азотемия
возникает при избыточном поступлении
азотсодержащих веществ в кровь, как
следствие усиленного распада тканевых
белков. Функция почек при этом, как
правило, не нарушена.
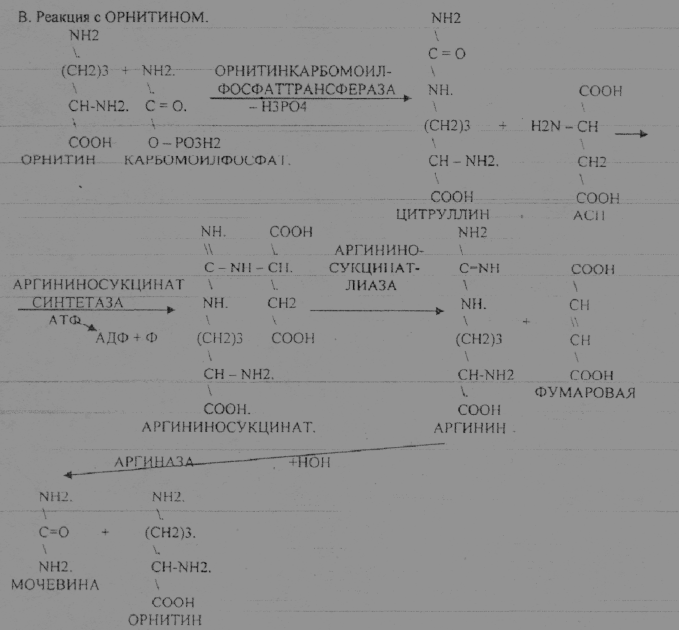
Синтез мочевины.
Аммиак
тем или иным путем поступивший в печень
или образовавшийся в гепатоцитах
вступает в цикл мочевинообразования
открытый в 1932 г.
Синтез
мочевины начинается с образования в
митохондриях печени карбомоилфосфата.
Вторая
реакция мочевинообразования протекает
так же в митохондриях (трансфераза
обеспечивает перенос остатка карбомонила
на молекулу арнитина-монокарбоновая
кислота содержащая 5 углеродных атомов).
Образуется аминокислота — цитрулин.
Дальнейшие
реакции мочевинообразования протекают
в цитозоле. В следующей реакции участвует
цитрулин и аспартат (фермент —
аргининосукцинатсинтетаза). В этой
реакции участвуют цитрулин и аспартат.
Реакция эгнергозависимая. В ходе реакции
происходит расщепление АТФ до АМФ и
пирофосфата и образуется аргининоянтарная
кислота или аргининосукцинат.
От
куда клетки находят аспартат?
Аспартат образуется в ходе реакций
трансаминирования из оксалоацетата —
промежуточного продукта цикла Кребса,
который подвергается реакции взаимодействия
с глутоматом и образуется аспартат.
Дальше
в ходе следующего процесса происходит
лиазная реакция (лиазное расщепление
— расщепление не гидролитическим путем)
(фермент- аргининосукцинатлиаза).
Происходит расщепление и в итоге
образуется аминокислота аргинин и
отщепляется остаток в виде фумаровой
кислоты.
Фумаровая
кислота — промежуточный продукт цикла
Кребса, присоединяя воду превращается
в малат, малат дегидрируется и превращается
в оксалоацетат, а оксалоацетат за счет
трансаминирования может превращаться
в аспартат, который поставляет один
атом азота.
Последняя
реакция мочевинообразования катализируемая
ферментом обладающим абсолютной
специфичностью аргиниза. Происходит
расщепление аргинина, образуется полный
амид угольной кислоты получивший
название мочевина и регенирирует
орнитин. Отсюда название цикла —
орнитиновый цикл мочевинообразования.
В
ходе следующей реакции арнитин вновь
вступая в реакцию взаимодействия с
карбомоилфосфататом может давать
цитрулин и дальнейшее повторение реакций
приводит к увеличению синтезированной
мочевины.
Необратимой
реакцией в этом процессе является
реакция с участием аргининосукцинатсинтетазы
— термодинамический контроль направления
процесса в целом.
Суммарное
уравнение мочевинообразования.
СО2
+ NH3
+ аспартат
+ 3АТФ + 2Н2О
мочевина + фумарат + 2AДФ
+ АМФ + 4Н3РО4
аспартат
СО2
NH3
H2N
— C — NH2
O
Синтез
идет из углекислого газа, аммиака,
Источником
углерода в мочевине является несомненно
углекислый газ.
Один атом азот происходит из аммиака,
а второй атом азота по происхождению
из аспартата. На синтез 1 молекулы
мочевины клетка затрачивает 4
макроэргических эквивалента. Причем
азот мочевины составляет примерно 50%
всего небелкового азота крови.
Необходимо
отметить, что количество мочевины
выводимое с мочой зависит от нескольких
факторов.
-
Снижение
содержания мочевины наблюдается при
снижении белка в пище. -
Количество
выводимой мочевины будет так же
уменьшаться при патологии почек, которое
сопровождается задержкой азотистых
шлаков в организме. -
Выведение
мочевины может снижаться при тяжелой
патологии печени как следствие нарушения
синтеза мочевины.
Что влияет на показатели
На концентрацию мочевины в крови влияют многие факторы:
- возраст — у детей уровень карбамида в крови ниже, чем у взрослых, причем следует отметить, что после 40 лет он постепенно увеличивается;
- время суток — уровню мочевины свойственны суточные колебания: в утренние часы ее концентрация на 20% выше, чем вечером;
- лекарственные препараты — гормональные, нефротические, диуретические, анальгетики приводят к повышению концентрации;
- питание — большое количество белковой пищи покажет завышенный уровень мочевины в крови, употребление растительной пищи приведет к снижению уровня;
- физические нагрузки — интенсивная нагрузка перед анализом может искажать результаты;
- беременность — концентрация мочевины снижается вследствие интенсивной работы почек и использования аминокислот для развития плода;
- вредные привычки: от употребления алкоголя и курения развивается гипоксия тканей;
- облучение ультрафиолетом — в результате длительного пребывания на солнце происходит разрушение свободных радикалов;
- лишний вес — чем больше мышечная масса, тем активнее делятся клетки.
Содержание карбамида может быть разным у людей в зависимости от группы крови. Отмечено, что у лиц с третьей группой крови уровень вещества выше.
Синтез мочевины орнитиновый цикл, последовательность реакций. Биологическая роль.
Синтез
мочевины — основной путь обезвреживания
аммиака — ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ

Образование
мочевины идёт только в печени. Две первые
реакции цикла (образование ЦИТРУЛЛИНА
и АРГИНИНОСУКЦИНАТА) идут в МИТОХОНДРИЯХ,
остальные в цитоплазме. В организме в
сутки образуется 25гр мочевины. Этот
показатель характеризует мочевино-
образующую функцию печени. Мочевина из
печени поступает в почки, где и выводится
из организма как конечный продукт
азотистого обмена.
26.
Обмен нуклеотидов. Образование мочевой
кислоты. Образование креатинина.
Нуклеотидами называются соединения,
состоящие из азотистого основания,
углевода-пентозы и фосфорной кислоты.
Примером может служить уридиловая
кислота:В типичном нуклеотиде связь
между атомом «N» цикла и первым
атомом углерода пентоза — b-N-гликозидная,
а связь между остатков фосфорной кислоты
и пятым атомом углерода пентозы —
сложноэфирная. 1. НУКЛЕОТИДЫ и АЗОТИСТЫЕ
ОСНОВАНИЯ (АО), поступающие с пищей, не
включаются в НУКЛЕОТИДЫ и НУКЛЕИНОВЫЕ
К-ТЫ организма.2. Клетки организма
человека синтезируют предшественники
НУКЛЕОТИДОВ. Исходя из этого,
доказательств опасности употребления
в пищу генно-инженерных продуктов
в настоящий момент нет.3. Помимо
синтеза включаются механизмы
реутилизации ПУРИНОВЫХ и
ПИРИМИДИНОВЫХ оснований, образующихся
при деградации нуклеиновых кислот.4.
Можно использовать аналоги ПУРИНОВ
и ПИРИМИДИНОВ как антиканцерогенные
вещества путём включения их в ДНК и
РНК.Мочевая кислота явл. конечным
продуктом распада ПУРИНОВЫХ НУКЛ.
Уровень мочевой кислоты свидетельствует
об интенсивности распада ПУРИНОВЫХ
оснований тканей организма и пищи.
НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ. ГИПЕРУРИКЕМИЯ
— повышение уровня мочевой кислоты в
крови указывает на повышенный распад
нуклеиновых кислот или пуриновых
нуклеотидов.(подагру). Заболевание
генетически детерминировано и носит
семейный характер. При подагре кристаллы
мочевой кислоты откладываются в суставных
хрящах, синовиальной оболочке, клетчатке.
Развивается тяжелый острый механический
подагрический артрит и нефропатии.
КРЕАТИНИН
образуется из креатина, который в свою
очередь синтезируется в печени из
аминокислот,
затем транспортируется в мышечную
ткань, где взаимодействует с АТФ.
Окисление
мочевой кислоты — окисление ПУРИНОВЫХ
НУКЛЕОЗИДОВ.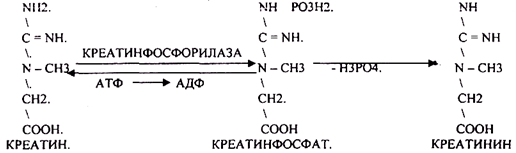 КРЕАТИНИН
КРЕАТИНИН
является конечным продуктом распада
креатина. Он поступает в кровь и выделяется
с мочой. КРЕАТИНИН не подвергается
обратному всасыванию и является
показателем фильтрационной способности
почек. При её нарушении уровень КРЕАТИНИНА
в моче будет понижаться, а в крови —
повышаться,._
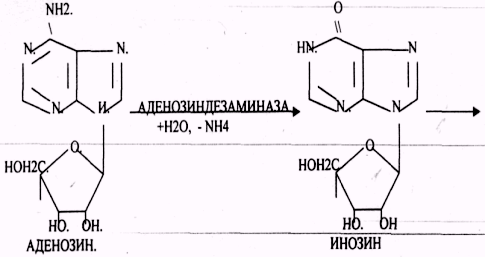

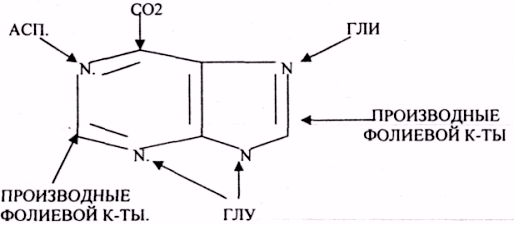
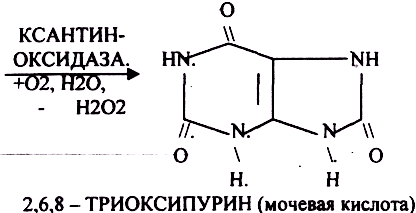
Мочевая
кислота является конечным продуктом
распада ПУРИНОВЫХ НУКЛ.

Уровень
мочевой кислоты свидетельствует об
интенсивности распада ПУРИНОВЫХ
оснований тканей организма и пищи.
НАРУШЕНИЕ
ОБМЕНА НУКЛЕОТИДОВ. ГИПЕРУРИКЕМИЯ —
повышение уровня мочевой кислоты в
крови указывает на повышенный распад
нуклеиновых кислот или пуриновых
нуклеотидов.(подагру). Заболевание
генетически детерминировано и носит
семейный характер. При подагре кристаллы
мочевой кислоты откладываются в суставных
хрящах, синовиальной оболочке, клетчатке.
Развивается тяжелый острый механический
подагрический артрит и нефропатии.
Карбамоильная группа
|
Прибор для определения алкоксигрупп. |
Карбамоильная группа OCONH2 является общей функциональной группой для эфиров карбаминовой кислоты.
Перенос карбамоильной группы с карбамоилфосфата на аспартат; ( рис. 14 — 29, стадия а) приводит к образованию продукта, способного к немедленной циклизации путем элиминирования воды; в результате образуется дигидрооротат. Карбамоилтрансфераза является в высокой степени регулируемым ферментом, и в настоящее время она служит объектом интенсивных исследований ( гл. Дигидрооротат окисляется особым флавопротеидом за счет NAD, являющегося внешним окислителем.
Замена метила в карбамоильной группе на этил существенно не изменяет токсичности соединения, но с увеличением числа атомов углерода при азоте инсектицидная активность соединения уменьшается. При замене второго атома водорода при азоте на углеводородный радикал инсектицидность также снижается. При замене этого водорода на карбалкоксильный радикал или формильный остаток инсектицидность соединения существенно не снижается, но повышается токсичность для млекопитающих. Инсектицидными свойствами обладают также соединения, содержащие дипептидные группы, концевой карбоксил которых этерифицирован низшим спиртом.
Это указывает также на отсутствие сопряжения между атомом фосфора и карбамоильной группой, поскольку атом азота образует значительно более прочные ря — РЯ-СВЯЗИ.
Полученные из аминогуанидина или замещенных семикарбазонов фор-мазаны, в которых гуанильная или замещенная карбамоильная группа присоединена к гидразонной части молекулы, могут служить основой для синтеза 2 5-дизамещенных тетразолов.
|
Карбамоилфосфат. Он представляет собой ацилфосфат-смешанный ангидрид карбоновой и фосфорной кислот. Вследствие этого он является высокоэнергетическим соединением. Карбамоильная группа выделена красным.| Образование цитруллииа из орни-тина из карбамоилфосфата. Включившаяся карбамоильная группа выделена красным. |
Карбамоилфосфат-синтетаза I представляет собой регуляторный фермент; положительным, или активирующим, модулятором служит для нее N-ацетилглу-тамат. Карбамоилфосфат ( рис. 19 — 19) принадлежит к высокоэнергетическим соединениям; его можно считать активированным донором карбамоильных групп. Отметим, что при образовании одной молекулы карбамоилфосфата используются концевые фосфатные группы двух молекул АТР.
Деструктивные исследования показали, что новобиоцин состоит из молекулы сахара, соединенной с ароматической гетероциклической системой. Этот углевод содержит карбамоильную группу, две метоксигруппы, одну свободную гидроксильную группу и гел-диметильную группировку. Было установлено, что по структуре он представляет собой метил-3 — О-карбамоилновиозид LVIII. Найдено, что он устойчив к окислению периодатом, но образующийся после кислотного гидролиза сахар, 3 — 0-карбамоил-новиоза LIX, поглощает 1 же периодата с образованием 1 моль муравьиной кислоты. Щелочной гидролиз соединения LVIII приводит к образованию двуокиси углерода, аммиака и а-метилновиозида LX. Гликозид LX, реагируя с 1 моль периодата, переходит в диальдегид, из которого при мягком гидролизе получается глиоксаль. Сходные результаты были получены при метанолизе LVIII в кислой среде, за исключением того, что в этом случае соединение LX представляло собой смесь а — и р — метилновиозидов. Полученная из LX при кислотном гидролизе новиоза LXI реагировала с 2 же периодата с образованием 2 же муравьиной кислоты.
В УФ-спектрах продуктов перегруппировки наблюдается появление дополнительной длинноволновой полосы в области — 280 нм ( спирт), в то время как у производных карбамоиларилгидроксиламияов присутствует лишь одна полоса в области — 240 нм. X ( в случае альтернативного лереацилировакия к атому азота карбамоильной группы) свидетельствуют данные ИК-спектров, где картина полос колебаний карбонильных групп практически не меняется в растворителях различной полярности.
Список источников
- tvoianalizy.ru
- realysm.ru
- www.ngpedia.ru
- StudFiles.net
