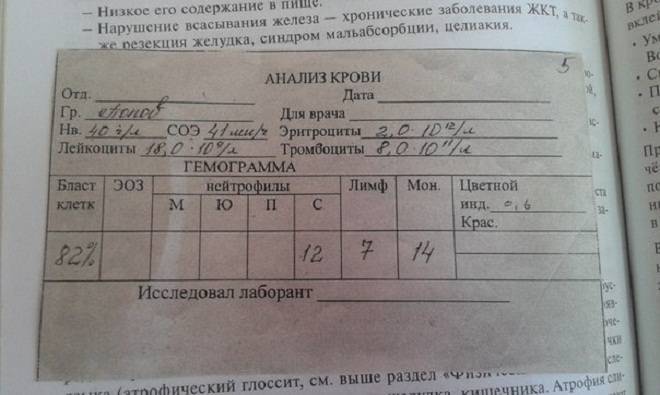
Лейкемический провал
Непреходящая слабость, частые ангины, внезапно появившаяся одышка при физической нагрузке – на подобные неспецифические симптомы острого лейкоза люди реагируют не сразу. Недомогания начинают лечить привычными средствами – витаминами, антибиотиками или обращаются за помощью к кардиологу. Правильным решением в подобных ситуациях является обращение к врачу за направлением на общий анализ крови. Именно он является самым первым и надежным способом диагностики острого лейкоза. И главным показателем в нем является лейкемический провал.
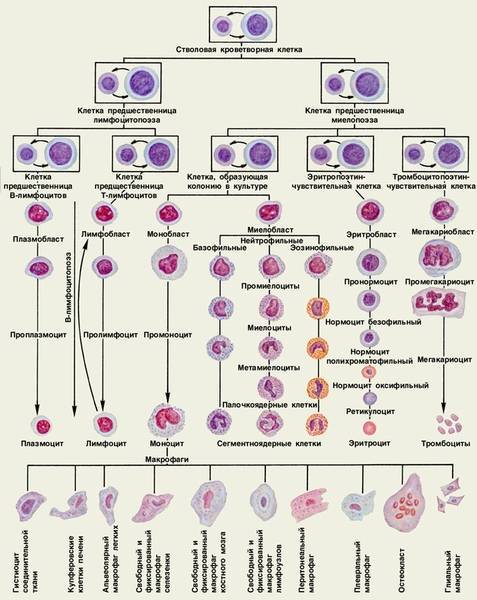
Что такое бластная клетка?
В норме в красном костном мозге – главном кроветворном органе – существует пять ростков кроветворения. Основой для них являются стволовые клетки, из которых затем образуются эритроциты, тромбоциты, лейкоциты и другие форменные элементы крови. В общую кровеносную систему (периферическую кровь) у здорового человека попадают уже сформировавшиеся «узкоспециализированные» клетки крови. Процесс их формирования идет непрерывно, так как срок жизни взрослых клеток невелик, и они постоянно нуждаются в замене молодыми элементами.
Из стволовых клеток образуются специализированные бласты, прошедшие определенную цепочку преобразований и присоединившиеся к тому или иному ростку кроветворения. Например, из миелобластов затем образуются гранулоциты (эозинофилы, базофилы и нейтрофилы), которые составляют основу иммунной защиты организма. В норме бластные клетки никогда не выходят за пределы костного мозга и не попадают в периферическую кровь.
Что происходит при остром лейкозе?
Если костный мозг поражен раковой опухолью, процесс созревания клеток нарушается. Наступает неконтролируемое деление (пролиферация) бластных клеток, утративших способность к дифференцированию. Эти незрелые клетки накапливаются в костном мозге и вытесняют здоровые гемопоэтические клетки. Это значит, что не могут полноценно развиваться и формироваться другие элементы крови — эритроциты, тромбоциты, гранулоциты, лимфоциты и моноциты.
Бесконтрольно размножающиеся бластные клетки выходят за пределы костного мозга и попадают в кровеносную систему, где и выявляются с помощью общего анализа крови. Поскольку они не в состоянии производить гранулоциты, то в крови не наблюдается молодых клеток эозинофилов и базофилов, являющихся разновидностями белых клеток – лейкоцитов (в анализах – 0%). В кровотоке циркулирует только небольшое количество зрелых элементов. Вместо новых созревающих клеток обнаруживается большое количество бластов – до 85 – 90%. Это и называется лейкемическим провалом. Из всех видов острого лейкоза он характерен для недифференцируемого и миелобластного лейкоза.
В каком случае нужно срочно делать анализ крови?
Острый лейкоз проявляется симптомами уже на ранней стадии, но они характерны и для других заболеваний. Особенность симптоматики обусловлена именно лейкемическим провалом, так как в этом случае в первую очередь страдает иммунная система. Также симптоматика будет зависеть и от того, какой кроветворный росток страдает от раковых клеток. К первым признакам острого лейкоза относят:
- анемию, бледность и кровоточивость при нехватке эритроцитов;
- беспричинные синяки и долго не заживающие ссадины при недостатке тромбоцитов;
- частые инфекционные заболевания (ангины, гингивиты, бронхиты, пневмонии), боли в суставах и костях при дефиците лейкоцитов.
- развитие в полости рта некротических процессов – изъязвление и постоянная кровоточивость десен, опухание и бледность слизистой оболочки, увеличение миндалин.
Тревожным симптомом является постоянная усталость и слабость, а также увеличение лимфатических узлов, печени и селезенки. Постоянная повышенная температура и полное угнетение иммунитета наблюдается уже на поздних стадиях острого лейкоза.
Острый лейкоз имеет быстрое течение. Раннее обращение за медицинской помощью и своевременная диагностика болезни позволит продлить жизнь больному.
Кроветворная система
Наиболее выраженное патологическое влияние углеводороды нефти оказывают на кроветворную систему. Alderson, 1981) считают наиболее типичным развитие лейкопении. Содержание лейкоцитов обычно снижается до 4 5 — 3 5ХЮ 9 г / л за счет уменьшения числа нейтрофилов, лимфоцитов ( Г. И. Алтухова, 1962; Green. Происходит не только количественное снижение элементов крови, но меняются их физико-химический состав и функциональные возможности.
Для работы с кобальтом противопоказанием служат все болезни крови и кроветворной системы.
Для работы с кобальтом противопоказанием служат все болезни кровн и кроветворной системы.
Применяют его внутривенно при лечении таких тяжелых заболеваний, как злокачественные новообразования кроветворной системы и лимфатических узлов.
При однократном остром облучении сравнительно большими дозами больше всего страдает костный мозг — основная кроветворная система организма, затем селезенка, лимфоидная ткань и кишечник. Это как раз те ткани и органы, где наблюдаются интенсивные процессы обмена, в особенности процессы синтеза нуклеиновых кислот, и связанные с ними процессы деления и возникновения новых клеток. Как отмечено многими исследователями, обмен нуклеиновых кислот является одним из процессов обмена наиболее поражаемых излучением, и следовательно, указанные выше органы и ткани страдают сильнее всего и даже доходят до состояния, несовместимого с нормальной жизнедеятельностью животного. Ниже кратко излагаются самые общие изменения, характерные для отдельных видов обмена веществ при действии ионизирующих излучений.
|
Токсические и неопластические угрозы.| Угрозы травматизма. |
Фермеры подвергаются повышенному риску некоторых специфических форм рака — мозга, желудка, лимфатической и кроветворной системы, губы, простаты и кожи.
Наибольшее распространение и известность получил в настоящее время тиоТЕФ, который применяют при злокачественных заболеваниях кроветворной системы, а также при раке грудной железы, яичников, шейки матки.
В связи с цитостатическим действием бис-бета-хлорэтилами-ны и аналогичные им вещества были предложены для лечения больных с опухолевыми заболеваниями кроветворной системы.
|
Изменения массы селезенки ( /, тимуса ( 2, величины абортивного подъема нейтрофилов ( 3 и числа лейкоцитов ( 4 после ЭМИ и 7-облу-чения.| Гибель мышей при воздействии только ЭМИ и при воздействии ЭМИ и 7-излучения. |
Несколько слов о восстановлении кроветворения после воздействия ЭМИ, оцениваемом методом дополнительного воздействия ионизирующего излучения в дозах, адресованных к кроветворной системе.
|
Влияние предварительного микроволнового воздействия в дозе 18 Дж / г ( 24 Дж / см2 в течение 10 сут ( 180 Дж / г на ЛДзо ПРИ 7 облучении. Заштрихованная зона — доверительный интервал ЛД5о при одном 7-облучении. |
Таким образом, в условиях предварительного воздействия ЭМИ синергизм с 7 излучением выявляется при дозах, при которых смертельный исход обусловлен поражением кроветворной системы. Синергизм неионизирующего и ионизирующего излучений не обнаруживается на уровне доз, отражающих поражение желудочно-кишечного тракта.
Заметная чувствительность терапевтического фактора к нагреванию и к ионизирующему излучению in vivo и in vitro сходна с этими свойствами живых клеток кроветворной системы.
В ряде работ отечественных авторов установлено влияние солнечной активности ( числа Вольфа, или площадь солнечных пятен) на клеточный состав крови и кроветворную систему. Кровь и кроветворная система человека являются чувствительными индикаторами различных излучений и могут быть моделью для изучения влияния солнечной активности. Данные различных авторов по этому вопросу не всегда однозначны. Несомненно только одно — солнечная активность влияет на численность клеток крови и скорость оседания эритроцитов.
Кровяные пластинки тромбоциты
Кровяные пластинки (тромбоциты) представляют отшнурования протоплазмы особых клеток (мегакариоцитов). Пластинки лишены, как и эритроциты, ядра, чрезвычайно нестойки в периферической крови, легко склеиваются в пластинчатый тромб; при повреждении сосудов они разрушаются и освобождают при этом вещества, которые способствуют свертыванию крови.
В патологических условиях в костном мозгу и периферической крови могут происходить значительные изменения качественного и количественного характера в отношении как костномозговых форм лейкоцитов, так и эритроцитов, и тромбоцитов.
При апластической анемии костномозговое кроветворение прекращается, и активный костный мозг замещается недеятельным слизистым. При агранулоцитозе поражается только лейкобластический росток костного мозга. Напротив, при лейкоцитозах костномозговое кроветворение увеличивается за счет нарастания числа промиэлоцитов и миэлоцитов нейтрофильных, эозинофильных; может быть увеличено число патологических форм раздражения—плазматических клеток или дегенеративных нейтрофилов с крупной токсической зернистостью и т. д. При лейкемиях резко увеличивается также число материнских клеток—недифференцированных миэлобластов. (При гемоцитобластических и лимфатических лейкемиях разрастание гемоцитобластов и лимфобластов происходит и в костном мозгу.) При тромбопенической пурпуре мегакариоциты в костном мозгу неполноценны, хотя и могут быть увеличены в числе.
При регенеративных анемиях эритробластический росток представлен большим числом нормобластов или эритробластов, а в редких случаях, преимущественно при злокачественном малокровии в периоды ухудшения заболевания, и не свойственными взрослому организму мегалобластами.
Стволовые кроветворные клетки.
Родоначальницей
всех клеток крови является стволовая
кроветворная клетка (СКК). По своей
морфологии СКК не отличается от лимфоцита.
Существование СКК в 1961 году доказали
J.E.Till и E.A.A.McCullough с помощью культуральных
иследований, в результате которых было
установлено, что при пересадке донорского
костного мозга облученной мыши в ее
селезенке развиваются очаги кроветворения,
представляющие собой потомство одной
клетки (так называемой колониеобразующей
единицы селезенки или КОЕс),
способной дифференцироваться по всем
росткам кроветворения.
Основными
свойствами популяции СКК являются
полипотентность (возможность
дифференцироваться по всем росткам
кроветворения) и способность к
самоподдержанию (дифференцировка одной
СКК сопровождается делением другой
СКК, в связи с чем появляется новая,
“дочерняя” СКК, и суммарное количество
клеток не уменьшается). В результате
последовательных делений и дифференцировок
из одной СКК образуется около 106
зрелых клеток.
Потомками
СКК являются миелоидная и лимфоидная
СКК, которые способны дифференцироваться,
соответственно, в клетки миелоидного
и лимфоидного ряда. Следующим классом
клеток-предшественниц в лимфоцитарном
ряду являются пре-В и пре-Т-клетки, в
миелоидном — смешанная КОЕ (КОЕ-ГЭММ),
способная дифференцироваться в
эритроидные, гранулоцитарные, моноцитарные
и мегакариоцитарные клетки. Потомки
КОЕ-ГЭММ имеют все более низкий
дифференцировочный потенциал:
клетки-предшественницы гранулоцитов
и моноцитов (КОЕ-ГМ), гранулоцитов
(КОЕ-Г), эозинофилов (КОЕ-Эоз), базофилов
(КОЕ-Баз), мегакариоцитов (КОЕ-Мег),
эритроцитов (бурстобразующая единица
— БОЕ-Э). Морфологически все эти клетки
также не отличаются от лимфоцитов, и их
наличие доказывается культуральными
методами. По мере дифференцировки и
созревания клеток-предшественниц их
способность к самоподдержанию снижается.
Изучение
СКК затруднено в связи с их малым
количеством в костном мозге (0,05% или 1
клетка на 2000). С помощью иммунофенотипирования
и молекулярно-генетических методов
установлено, что все СКК экспрессируют
антиген CD34 и рецептор C-kit. В ряде случаев
СКК позитивны по антигенам HLA-DR, CD38 и
Thy+.
Культуральными исследованиями доказана
высокая колониеобразующая способность
СКК и их способность к длительному
самоподдержанию. Направление
дифференцировки СКК определяется
кроветворным микроокружением.
Важное
влияние на процессы самоподдержания и
дифференцировки СКК оказывают
гепомоэтические ростовые факторы.
Некоторые из них (ИЛ-1, ИЛ-6) могут выступать
как пусковой механизм, запускающий
“дремлющие” СКК в пролиферацию; другие
(гранулоцитарный колониестимулирующий
фактор, фактор стволовых клеток, ИЛ-3),
напротив, способствуют длительному
сохранению СКК в фазе G
Кроветворение в антенатальном периоде
Кроветворение в антенатальном периоде впервые обнаруживается у 19-дневного эмбриона в кровяных островках желточного мешка, в стебле и хорионе. К 22-му дню первые кровяные клетки проникают в мезодермальную ткань эмбриона, в сердце, аорту, артерии. На 6-й нед. снижается активность К. в желточном мешке. Полностью первый (мезобластический) период гемопоэза, преимущественно эритроцитопоэза, заканчивается к началу 4-го мес. жизни эмбриона. Примитивные кроветворные клетки желточного мешка накапливают гемоглобин и превращаются в примитивные эритробласты, названные П. Эрлихом мегалобластами.
Второй (печеночный) период К. начинается после б нед. и достигает максимума к 5-му мес. К. этого периода преимущественно эритроидное, хотя на 9-й нед. в печени уже созревают первые нейтрофилы. Печеночный период эритроцитопоэза характеризуется исчезновением мегалобластов; при этом эритрокариоциты имеют нормальные размеры. На 3-м мес. эмбриональной жизни в эритроцитопоэз включается селезенка, но у человека ее роль в пренатальном К. ограничена.
На 4-5-м мес. начинается третий (костномозговой) период К. Миелоидный эритроцитопоэз плода — эритробластический и, как и лейкоцитопоэз, мало отличается от эритроцитопоэза взрослого.
Общей закономерностью эмбрионального эритроцитопоэза является постепенное уменьшение размеров эритроцитов и увеличение их числа. Соответственно различным периодам К. (мезобластическому, печеночному и костномозговому) существует три разных типа гемоглобина: эмбриональный, фетальный и гемоглобин взрослого. В основном переход от фетального гемоглобина к гемоглобину взрослого начинается на 3-й нед. жизни плода и заканчивается через 6 мес. после рождения.
В первые дни у новорожденных наблюдается полиглобулия и нейтрофильный лейкоцитоз. Затем активность эритроцитопоэза снижается. Нормализуется он в возрасте 2-3 мес. Нейтрофилез первых дней жизни сменяется лимфоцитозом; только к 5 годам в лейкоцитарной формуле начинают преобладать нейтрофилы.
Дифференцировка клеток эритроидного ряда
Собственно эритроидный ряд клеток (эритрон) начинается с унипотентных бурстобразующих клеток, являющихся потомками клеток-предшественниц миелопоэза. Бурстобразующие клетки в культуре тканей растут мелкими колониями, напоминающими взрыв (бурст). Для их созревания необходим специальный медиатор — бурстпромоторная активность. Это фактор влияния микроокружения на созревающие клетки, фактор межклеточного взаимодействия.
Выделяют две популяции бурстобразующих клеток: первая регулируется исключительно бурстпромоторной активностью, вторая — становится чувствительной к воздействию эритропоэтина. Во второй популяции начинается синтез гемоглобина
, продолжающийся в эритропоэтин-чувствительных клетках и в последующих созревающих клетках.
На этапе бурстобразующих клеток происходит принципиальное изменение клеточной активности — от деления к синтезу гемоглобина. В последующих клетках деление приостанавливается (последняя клетка в этом ряду, способная к делению, — полихроматофильный эритробласт), ядро уменьшается в абсолютном размере и по отношению к объему цитоплазмы, в которой идет синтез веществ. На последнем этапе ядро из клетки удаляется, затем исчезают остатки РНК; их можно еще обнаружить при специальной окраске в молодых эритроцитах — ретикулоцитах, но нельзя найти в зрелых эритроцитах.
Cхема основных этапов дифференцировки клеток эритроидного ряда выглядит следующим образом:плюрипотентная стволовая клетка ⭢ бурстобразующая единица эритроидного ряда (БОЕ-Э) ⭢ колониеобразующая единица эритроидного ряда (КОЕ-Э) ⭢ эритробласт ⭢ пронормоцит ⭢ базофильный нормоцит ⭢ полихроматический нормоцит ⭢ ортохроматический (оксифильный) нормоцит ⭢ ретикулоцит ⭢ эритроцит
.
Что такое гемопоэз и последствия его нарушений
Кроветворение – это очень сложный процесс, он должен постоянно регулироваться и никак не изменяться. Любое изменение в ту или иную сторону приводит к нарушениям в организме и к возникновению различных заболеваний. Гемопоэз, что это такое и с чего он начинается, рассмотрим ниже.
В первые дни жизни эмбриона кроветворение происходит в стенках желчного мешка, в его утолщениях. Начало этого процесса приходится на 16-19 день развития, а после 60-го дня кроветворение начинает происходить в печени, селезенке и в тимусе. Затем, когда развился костный мозг (а он развивается самым последним из кроветворных органов), эти функции переходят к нему. Тогда в печени активное образование крови прекращается.
Как уже упоминалось выше, из стволовых клеток образуются миелоидные клетки (эритроциты, моноциты, тромбоциты, гранулоциты). Этот процесс получил название миелопоэз. Выработка предшественников лимфоидных клеток – лимфопоэз. Процесс миелопоэза осуществляется в миелоидной ткани, которая находится трубчатых, а также во многих губчатых костях. Во время миелопоэза происходит изменение типа клеток. Например, прежде чем стать тромбоцитами, меняется кариотип полиплоидных мегакариоцитов, а при образовании эритроцитов исчезает ядро у клеток эритробласт.
Селезенка, лимфатические узлы, тимус (вилочковая железа) и костный могз отвечают за протекание лимфопоэза. В лимфоидной ткани происходит образование лимфоцитов, плазмоцитов, а также удаляются клетки и остатки из распада.
При некоторых заболеваниях возникают нарушения в костном мозге, что приводит к нарушению кроветворения. Например, при увеличении количества тромбоцитов становится гуще кровь, что может привести к застою крови в различных органах, замедлению кровотока и образованию тромбов, что является большой опасностью для жизни человека.
Если же клеток крови вырабатывается недостаточно, то симптомы проявляются по мере того, как отмирают нормальные клетки. Самыми «маложивущими» являются гранулоциты, поэтому при их исчезновении организм становится более уязвимым для различных инфекций. Потом начинают убывать эритроциты, что проявляется в тромбоцитопении. Появляется кровоточивость. А при уменьшении количества эритроцитов характерными признаками являются бледность, общая слабость, одышка даже при, казалось бы, небольших нагрузках.
Познания в этой области улучшились только недавно, когда генная инженерия и культивирование клеток достигли нового уровня. Появилась возможность регулировать процесс кроветворения, подходя к этому индивидуально, в зависимости от того, сколько клеток недовырабатывается.
Следите за своим здоровьем! И будет не лишним узнать какие причины низкого гемоглобина в крови, и как бороться с проблемами такого характера.
Селезенка
Селезенка—незначительный по величине орган (весом около 180—200 г)—по богатству ретикуло-эндотелиальной ткани и особенностям кровообращения играет большую роль в ряде функций организма.
- Кроветворение совершается в селезенке как в отношении лимфатической системы (в фолликулах), так и моноцитарной (в ее ретикуло-эндотелиальной части). Однако у взрослого при внекостномозговом (экстрамедуллярном) кроветворении в патологических условиях легко происходит возврат как по линии эритробластического, так и по линии лейкобластического ростка к миэлоидному кроветворению, имеющему нормально место в селезенке в эмбриональном периоде. Несомненно влияние селезенки на нормальное вызревание эритроцитов в костном мозгу, так как после ее удаления в крови всегда имеются эритроциты с мельчайшим точковидным остатком ядра (тельца Жолли).
- В отношении красной крови совершенно определенно установлено роль селезенки как органа эритрофагоцитоза (впервые доказанная для эндотелиальных клеток селезенки в печени Линтваревым), а в патологических условиях—как органа гуморального торможения костномозгового эритропоэза. Отмирающие эритроциты поглощаются ретикуло-эндотелиальными клетками красной пульпы и синусов селезенки. Распаду эритроцитов могут способствовать и физико-химические условия в застойной крови в петлях красной пульпы селезенки. В селезенке из гемоглобина распавшихся эритроцитов образуется билирубин, поступающий через селезеночную вену в общий кровоток, а также железо, частично откладывающееся в селезенке. В селезенке происходит распад и лейкоцитов (лейколиз), н кровяных пластинок. В патологии при спленогенных анемиях, наряду с низкими цифрами эритроцитов и гемоглобина, при низком цветном показателе, обычно находят и лейкопению, и тромбопению. Это торможение всех трех костномозговых ростков проявляется в патологии более определенно, чем указанное в предыдущем параграфе обратного порядка влияние селезенки на костномозговой эритропоэз.
- Фагоцитарная кровоочистительная функция, функция ретикуло-эндотелиальной ткани селезенки распространяется и на поглощение бактерий, простейших малярии, висцерального лейшманиоза, взвеси коллоидных красок, липоидов и т. д., а также на образование антител противоинфекционных, противоопухолевых и т. д. Таким образом, селезенка чувствительно реагирует на инфекции, участвует в обмене веществ, в системных ретикуло-эндотелиозах.
- Селезенка участвует в кровообращении, являясь депо крови, о чем упоминалось в главе о болезнях сердечно-сосудистой системы. Острое увеличение селезенки при инфекциях зависит, как показал С. П. Боткин, от паралитического ее полнокровия, а в дальнейшем—от серозного отека, клеточной гиперплазии, захватывания микробов и т. д.
Условия кровообращения в селезенке с многочисленными ее синусами, куда кровь поступает непосредственно из артерий, способствуют, с одной стороны, депонированию крови, а с другой—более длительному контакту клеточных элементов селезенки как с инфекционным возбудителем, так и с фагоцитируемыми эритроцитами.
Кроме того, гемопоэз подразделяется на два периода
- эмбриональный;
- постэмбриональный.
Эмбриональный период гемопоэза
приводит к образованию крови как ткани и потому представляет собой гистогенез крови
. Постэмбриональный гемопоэз
представляет собой процесс физиологической регенерации
крови как ткани.
Эмбриональный период гемопоэза осуществляется поэтапно, сменяя разные органы кроветворения. В соответствии с этим эмбриональный гемопоэз
подразделяется на три этапа:
- желточный;
- гепато-тимусо-лиенальный;
- медулло-тимусо-лимфоидный.
Наиболее важными моментами желточного этапа являются:
- образование стволовых клеток крови;
- образование первичных кровеносных сосудов.
Несколько позже (на 3-ей неделе) начинают формироваться сосуды в мезенхиме тела зародыша, однако они являются пустыми щелевидными образованиями. Довольно скоро сосуды желточного мешка соединяются с сосудами тела зародыша, по этим сосудам стволовые клетки мигрируют в тело зародыша и заселяют закладки будущих кроветворных органов (в первую очередь печень), в которых затем и осуществляется кроветворение.
Гепато-тимусо
—лиенальный
этап гемопоэза осуществляется в начале в печени, несколько позже в тимусе (вилочковой железе), а затем и в селезенке. В печени происходит (только экстраваскулярно) в основном миелоидное кроветворение, начиная с 5-ой недели и до конца 5-го месяца, а затем постепенно снижается и к концу эмбриогенеза полностью прекращается. Тимус закладывается на 7-8-й неделе, а несколько позже в нем начинается Т-лимфоцитопоэз, который продолжается до конца эмбриогенеза, а затем в постнатальном периоде до его инволюции (в 25-30 лет). Процесс образования Т-лимфоцитов в этот момент носит название антиген независимая дифференцировка
. Селезенка закладывается на 4-й неделе, с 7-8 недели она заселяется стволовыми клетками и в ней начинается универсальное кроветворение, то есть и миелоилимфопоэз. Особенно активно кроветворение в селезенке протекает с 5-го по 7-ой месяцы внутриутробного развития плода, а затем миелоидное кроветворение постепенно угнетается и к концу эмбриогенеза (у человека) оно полностью прекращается. Лимфоидное же кроветворение сохраняется в селезенке до конца эмбриогенеза, а затем и в постэмбриональном периоде.
Следовательно, кроветворение на втором этапе в названных органах осуществляется почти одновременно, только экстраваскулярно, но его интенсивность и качественный состав в разных органах различны.
Медулло-тимусо-лимфоидный этап кроветворения
Закладка красного костного мозга начинается со 2-го месяца, кроветворение в нем начинается с 4-го месяца, а с 6-го месяца он является основным органом миелоидного и частично лимфоидного кроветворения, то есть является универсальным
кроветворным органом. В то же время в тимусе, в селезенке и в лимфатических узлах осуществляется лимфоидное кроветворение. Если красный костный мозг не в состоянии удовлетворить возросшую потребность в форменных элементах крови (при кровотечении), то гемопоэтическая активность печени, селезенки может активизироваться — экстрамедуллярное кроветворение.
Постэмбриональный период кроветворения — осуществляется в красном костном мозге и лимфоидных органах (тимусе, селезенке, лимфатических узлах, миндалинах, лимфоидных фолликулах).
Сущность процесса кроветворения заключается в пролиферации и поэтапной дифференцировке стволовых клеток в зрелые форменные элементы крови.
Регуляция эритропоэза
Процессы регуляции кроветворения до сих пор изучены недостаточно. Необходимость непрерывно поддерживать гемопоэз, адекватно удовлетворять потребности организма в различных специализированных клетках, обеспечивать постоянство и равновесие внутренней среды (гомеостаз) — всё это предполагает существование сложных регуляторных механизмов, действующих по принципу обратной связи.
Наиболее известным гуморальным фактором регуляции эритропоэза, является гормон эритропоэтин
. Это стресс-фактор, синтезирующийся в различных клетках и в различных органах. Большее количество его образуется в почках, однако даже при их отсутствии эритропоэтин вырабатывается эндотелием сосудов, печенью. Уровень эритропоэтина стабилен и изменяется в сторону повышения при резкой и обильной кровопотере, остром гемолизе , при подъеме в горы, при острой ишемии почек. Парадоксально, что при хронических анемиях уровень эритропоэтина обычно нормален, за исключением апластической анемии, где его уровень стабильно чрезвычайно высок.
Наряду с эритропоэтином, в крови присутствуют также ингибиторы эритропоэза. Это большое число разнообразных веществ, часть из которых может быть отнесена к среднемолекулярным токсинам, накапливающимся вследствие патологических процессов, связанных с повышенным их образованием либо нарушением их выведения.
На ранних этапах дифференцировки регуляция в эритроне осуществляется в основном за счёт факторов клеточного микроокружения, а позже — при балансе активности эритропоэтина и ингибиторов эритропоэза. В острых ситуациях, когда необходимо быстро создать большое число новых эритроцитов, включается стрессовый эритропоэтиновый механизм — резкое преобладание активности эритропоэтина над активностью ингибиторов эритропоэза. В патологических ситуациях, напротив, ингибиторная активность может преобладать над эритропоэтиновой, что приводит к торможению эритропоэза.
Говяжья печень
Самый распространенный способ — употребление сырой говяжьей печени. Она действительно насыщена железом, а также другими микроэлементами и витаминами, поскольку играет роль кладовой, в которую складируются запасы нужных организму веществ. Но не стоит забывать и о том, что печень — это еще и мощный фильтр, который собирает из крови всю грязь.
Коров сегодня выращивают в условиях, далеких от идеальных. А именно: пасут не на экологически чистых пастбищах, а вдоль автомагистралей, где они поедают траву с тяжелыми металлами и канцерогенами. Кроме того, их подкармливают комбикормами со всевозможными химическими добавками для быстрого наращивания мяса. Этот хлам также оседает в их печени. А еще в ней могут жить паразиты — ими скот заражается от грызунов, которых сейчас развелось много. Поэтому, когда человек употребляет животную печень, то вместе с нужным ему железом получает целый набор вредных веществ.
Какой выход? Употреблять печень не в сыром или полусыром (с кровью) виде, а термически обработанной. Ее нужно варить или тушить с большим количеством овощей, которые после приготовления следует выбрасывать. Дело в том, что они являются превосходными сорбентами (очистителями), поэтому очистят продукт от токсинов, зато сами наполнятся ими.
Эмбриональное кроветворение.
Кроветворение во внутриутробном периоде
развития начинается рано. По мере роста
эмбриона и плода последовательно
меняется локализация гемопоэза в
различных органах.
Табл. 1. Развитие гемопоэтической системы
человека
(по Н.С. Кисляк, Р.В. Ленской, 1978).
|
Локализация кроветворения |
Период эмбриогенеза (недели) |
|
Желточный мешок |
3 – 4 |
|
Начало кроветворения в печени |
5 – 6 |
|
Появление больших лимфоцитов в тимусе |
9 – 10 |
|
Начало гемопоэза в селезенке |
Конец 12-й |
|
Появление гемопоэтических очагов в |
13 – 14 |
|
Лимфопоэз в лимфоузлах |
16 – 17 |
|
Появление циркулирующих малых |
17 |
|
Начало лимфопоэза в селезенке |
20 |
Начинается кроветворение в желточном
мешке на 3-й неделе развития человеческого
эмбриона. В начале оно сводится в основном
к эритропоэзу. Образование первичных
эритробластов (мегалобласты) происходит
внутри сосудов желточного мешка.
На 4-й неделе кроветворение появляется
в органах эмбриона. Из желточного мешка
гемопоэз перемещается в печень, которая
к 5-й недели гестации становится центром
кроветворения. С этого времени наряду
с эритроидными клетками начинают
образовываться первые гранулоциты и
мегакариоциты, при этом мегалобластический
тип кроветворения сменяется на
нормобластический. К 18-20-й неделе развития
человеческого плода кроветворная
активность в печени резко снижена, а к
концу внутриутробной жизни, как правило,
совсем прекращается.
В селезенке кроветворение начинается
с 12-й недели, образуются эритроциты,
гранулоциты, мегакариоциты. С 20-й недели
миелопоэз в селезенке сменяется
интенсивным лимфопоэзом.
Первые лимфоидные элементы появляются
на 9-10 неделе в строме тимуса, в процессе
их дифференцировки образуются
иммунокомпетентные клетки – Т-лимфоциты.
К 20-й неделе тимус по соотношению малых
и средних лимфоцитов сходен с тимусом
доношенного ребенка, к этому времени в
сыворотке крови плода начинают
обнаруживаться иммуноглобулины М и G.
Костный мозг закладывается в конце 3-го
месяца эмбрионального развития за счет
мезенхимальных периваскулярных
элементов, проникающих вместе с
кровеносными сосудами из периоста в
костномозговую полость. Гемопоэтические
очаги в костном мозге появляются с 13-14
недели внутриутробного развития в
диафизах бедренных и плечевых костей.
К 15-й неделе в этих локусах отмечается
обилие юных форм грануло-, эритро- и
мегакариоцитов. Костномозговое
кроветворение становится основным к
концу внутриутробного развития и на
протяжении всего постнатального периода.
Костный мозг в пренатальном периоде
красный. Его объем с возрастом плода
увеличивается в 2,5 раза и к рождению
составляет порядка 40 мл. и он присутствует
во всех костях. К концу гестации начинают
появляться в костном мозге конечностей
жировые клетки. После рождения в процессе
роста ребенка масса костного мозга
увеличивается и к 20 годам составляет в
среднем 3000 г, но на долю красного костного
мозга будет приходиться порядка 1200 г,
и он будет локализоваться в основном в
плоских костях и телах позвонков,
остальная часть будет замещена желтым
костным мозгом.
Основным отличие состава форменных
элементов крови плода является постоянное
нарастание числа эритроцитов, содержания
гемоглобина, количества лейкоцитов.
Если в первой половине внутриутробного
развития (до 6 месяцев) в крови обнаруживаются
много незрелых элементов (эритробластов,
миелобластов, промиелоцитов и миелоцитов),
то в последующие месяцы в периферической
крови плода содержатся преимущественно
зрелые элементы.
Изменяется и состав гемоглобина. Вначале
(9-12 нед) в мегалобластах находится
примитивный гемоглобин (HbP),
который заменятся фетальным (HbF).
Он становится основной формой в
пренатальном периоде. Хотя с 10-й недели
начинают появляться эритроциты с
гемоглобином взрослого типа (HbA),
доля его до 30 недели составляет лишь
10%. К рождению ребенка фетальный гемоглобин
составляет приблизительно 60%, а взрослый
– 40% всего гемоглобина эритроцитов
периферической крови
Важным физиологическим
свойством примитивного и фетального
гемоглобинов является их более высокое
сродство к кислороду, что имеет важное
значение во внутриутробном периоде для
обеспечения организма плода кислородом,
когда оксигенация крови плода в плаценте
относительно ограничена по сравнению
с оксигенацией крови после рождения в
связи с установлением легочного дыхания
Список источников
- www.sweli.ru
- www.my-doktor.ru
- www.medidi.ru
- www.ngpedia.ru
- stomator.ru
- StudFiles.net
- pro-gipertoniya.ru
- hematologiya.ru