Лекция 8 Тема Катаболизм глюкозы. Гликолиз.
Основные
пути катаболизма глюкозы
Катаболизм
глюкозы в клетке может проходить как в
аэробных, так и в анаэробных условиях,
его основная функция — это синтез АТФ.
В аэробных
условиях глюкоза окисляется до СО2и Н2О. Суммарное уравнение:
С6Н12О6+ 6О2→ 6СО2+ 6Н2О + 2880
кДж/моль.
Этот процесс
включает несколько стадий:
-
Аэробный
гликолиз— процесс окисления
глюкозы до 2 молекул ПВК, с образованием
2 молекул АТФ и 2 молекул НАДН2; -
Превращение
2 молекул ПВК в 2 молекулы ацетил-КоА с
выделением 2 молекул СО2и
образованием 2 молекул НАДН2; -
Окисление
2 молекул ацетил-КоА в ЦТКс
выделением 4 молекул СО2, образованием
2 молекул ГТФ (дают 2 АТФ), 6 молекул НАДН2и 2 молекул ФАДН2; -
Реакции
окисления 6 молекулами О2 10 (8)
молекул НАДН2, 2 (4) молекул ФАДН2с выделением 6 молекул Н2О и
синтезом 34 (32) молекул АТФв дыхательной
цепи окислительного фосфорилирования.
В результате аэробного окисления глюкозы
образуется 38 (36) молекул АТФ, из них: 4
АТФ в реакциях субстратного фосфорилирования,
34 (32) АТФ в реакциях окислительного
фосфорилирования. Если свободную энергию
полного распада глюкозы 2880 кДж/моль
сравнить с энергией гидролиза
высокоэнергетических связей 38 моль АТФ
(38 моль АТФ * 50 кДж на моль АТФ = 1900 кДж),
то КПД аэробного окисления составит
65%.
Катаболизм глюкозы без кислорода идет
в анаэробном гликолизе и ПФШ (ПФП). В
ходе анаэробного гликолизапроисходит окисления молекулы глюкозы
до 2 молекул молочной кислоты с образованием
2 молекул АТФ. В анаэробных условиях
гликолиз является единственным источником
энергии. Суммарное уравнение: С6Н12О6+ 2Н3РО4+ 2АДФ → 2С3Н6О3+ 2АТФ + 2Н2О.
Гормоны передней доли гипофиза, классификация, их химическая природа, участие в регуляции процессов метаболизма. Семейство пептидов проопиомеланокортина.
АДЕНОГИПОФИЗ
(выделяет тропные гормоны)
ТРОПНЫЕ
гормоны можно разделить на 3 группы в
зависимости от их химической природы:
1.
простые белки;
2.
ГЛИКОПРОТЕИНЫ;
3.
ПЕПТИДЫ, образующиеся из предшественников
ПРООПИОМЕЛАНОКОРПИНА (ПОМК).
Гормон
роста.
Усиливается ЛИПОЛИЗ
ВЖК
АЦЕТИЛ-КОА
ХОЛЕСТЕРОЛ. ГР близок по строению с ХС
на 85%, ПРЛ — на 35%. Секреция ГР эпизодическая.
Максимальная секреция в момент засыпания
или перед пробуждением. На секрецию
влияют стресс, голод, физические
упражнения. ГР сберегает глюкозу для
тканей.
Он
повышает ЛИПОЛИЗ,
повышается концентрация жирных кислот,
повышает транспорт в клетку
повышает концентрацию аминокислот
повышает ГЛЮКОНЕОГЕНЕЗ
повышение глюкозы
мозг.
Влияние
ГР на обмен веществ:
1.
Стимуляция синтеза белка: (через ИФР
I.)_
—
повышение транспорта аминокислот в
клетки,
—
повышение интенсивности процесса
трансляции,
—
повышение синтеза РНК и ДНК
2.
Влияние на углеводный обмен:
—
повышение глюкозы (уменьшение утилизации
глюкозы периферическими тканями,
стимуляция ГЛЮКОНЕОГЕНЕЗА),
3.
Влияние на минеральный обмен (через
ИФР1) — задержка кальция, фосфора, магния
в организме,
4.
Влияние на липидный обмен (не через ИФР
1): повышение ЛИПОЛИЗА, повышение окисления
ВЖК.
ГИПОСЕКРЕЦИЯ
в детском возрасте приводит к нарушению
синтеза белка, понижению минерализации
костной ткани, задержке роста и развитию
карликовости в нескольких вариантах.
ГИПЕРСЕКРЕЦИЯ
гормона роста в детском возрасте приводит
к развитию гигантизма, во взрослом
развитию акромегалии.
АКТГ
—
полипептид, состоящий из 39 аминокислот.
Клетки-мишени — клетки коры надпочечников.
Стимулирует синтез стероидов коры
надпочечников из холестерина через
ЦАМФ. Повышается АДЕНИЛАТЦИКЛАЗА в
жировой ткани.
Усиливается
ЛИПОЛИЗ
ВЖК
АЦЕТИЛ-КОА
ХОЛЕСТЕРОЛ. АКТГ стимулирует процессы
пентозного цикла и является поставщиком
НАДН2 Повышает синтез белка и нуклеиновых
кислот в надпочечниках. ГИПЕРСЕКРЕЦИЯ
проявляется в виде синдрома КУШИНГА.
Бета
-ЛИПОТРОПИН усиливает липолиз.
МСГ
стимулирует образование меланина.
ГЛИКОПРОТЕИНЫ.
Действуют через ЦАМФ.
ФСГ:
Женские клетки-мишени — фолликулярные
клетки яичника, мужские клетки-мишени
— клетки СЕРТОЛИ семенников.
В
женском организме стимулирует рост
фолликулов, подготавливают их к действию
ЛГ. В мужском организме индуцирует
синтез АНДРОГЕНСВЯЗЫВАЮЩЕГО белка.
Стимулирует рост семенных канальцев
семенников и сперматогенез.
Л
Г:
Женские клетки-мишени — клетки желтых
тел, Мужские клетки-мишени — клетки
ЛЕЙДЕГА.
Стимулирует
образование в женском организме
ПРОГЕСТЕРОНА, а в мужском -ТЕСТОСТЕРОНА.
Предшественником их является ХОЛЕСТЕРОЛ.
ЛГ индуцирует овуляцию у женщин. ХГЧ
синтезируется в плаценте и близок
по эффектам к ЛГ. Появляется в моче
после имплантации зародыша. Его
определение служит диагностическим
маркером беременности.
ТТГ:
Клетки-мишени — ТИРЕОЦИТЫ.
—
Повышает синтез ТРИЙОДТИРОНИНА и
ТИРОКСИНА.
—
Повышает гидролиз белка — ТИРЕОГЛОБУЛИНА.
—
Повышает включение йода в структуру
ТИРЕОИДНЫХ гормонов.
—
Стимулирует синтез белка и нуклеиновых
кислот в щитовидной железе
Биология — Протеинкиназы — Тирозиновые протеинкиназы
Протеинкиназы Серин/треонин специфичные протеинкиназы Гистидин специфичные протеинкиназы
Аминокислота L-тирозин
Тирозиновые протеинкиназы ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке. Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные.
Цитоплазматические протеинкиназы
Геном человека содержит 32 гена цитоплазматических тирозиновых протеинкиназ. Первым изученным геном тирозинкиназы, не связанной с рецептором, был ген из семейства Src, протоонкогенных тирозиновых киназ. Протеинкиназы этого семейства содержатся почти во всех клетках животных. Было показано, что вирус саркомы Рауса содержит мутантную копию нормального клеточного гена Src. Белки семейства Src регулируют многие процессы в клетке, участвуют в передаче интегрин-зависимых сигналов в клетку, которые побуждают её деление.
Геном ретровирусов может содержать ген v-src, который является онкогеном, он не содержит С-концевого участка, ингибирования фосфорилирования, и поэтому постоянно активен в клетке, чем отличается от c-src, которые активируется только некоторыми внешними сигналами, и является протоонкогеном.
TCR, передает сигнал внутрь клетки путем активирования двух белков Lck и Fyn, относящихся к семейству Src. Этот сигнал приводит к пролиферации Т-лимфоцитов и усилению клеточного иммунитета.
Рецепторы с тирозинкиназной активностью
Геном человека содержит 58 генов рецепторов-тирозинкиназ. Гормоны и факторы роста, которые взаимодействуют на поверхности клетки с рецепторами, обладающими тирозинкиназной акитвностью, как правило, вызывают рост клеток и стимулируют клеточные деления. Рецепторы с тирозинкиназной активностью располагаются на поверхности клеток и связывают полипептидные факторы роста, цитокины и гормоны. Такие рецепторы не только регулируют клеточные процессы, но и играют критическую роль в развитии многих видов рака.
Рецепторы с тирозинкиназной активностью по фосфорилируемому субстрату делят на двадцать семейств. Инсулиновый рецептор является мультимерным комплексом, однако большинство рецепторов с тирозинкиназной активностью имеют только одну субъединицу. Каждый мономер имеет один трансмембранный домен, состоящий из 25-38 аминокислотных остатков, внеклеточный N-концевой домен и внутриклеточный C-концевой домен. Внеклеточный домен очень крупный и отвечает за связывание лигандов, внутриклеточный участок содержит домены с киназной активностью. Когда фактор роста или гормон соединяется с внеклеточным доменом рецептора-тирозинкиназы, рецептор димеризуется. Димеризация рецепторов активирует цитоплазматические домены, которые осуществляют самофосфорилирование рецептора по многим аминокислотным остаткам.
Тирозиновые протеинкиназы принимают участие в передаче сигнала в клетке путем фосфорилирования специфических остатков тирозина белков-мишеней. Специфические белки, содержащие SH2-домены или домены связывания фосфотирозина, соединяются с рецептором и фосфорилируются внутриклеточным доменом. Фосфорилирование приводит к активации белков и инициирует пути сигнальной трансдукции. Активированные рецепторы могут взаимодействовать и с другими белками, не обладающими каталитическими активностями. Такие адапторные белки связывают рецепторы-тирозинкиназы со следующими этапами сигнальной трансдукции, например, с каскадом МАР-киназ.
|
Передача сигнала в клетке |
Регуляторные пептиды >>> |
История открытия и структура гена код
Ген тирозинкиназы Брутона был идентифицирован в 1993 году двумя независимыми группами как ген, вовлечённый в развитие агаммаглобулинемии (болезни Брутона). Было показано, что ген локализован в длинном плече Х-хромосомы. Ген тирозинкиназы Брутона имеет размер около 37,5 тысяч пар нуклеотидов и содержит 19 экзонов. Было идентифицировано более 1000 различных мутаций данного гена у пациентов с агаммаглобулинемией. На матрице гена синтезируется мРНК размером 2,7 тысяч нуклеотидов. Данных о возможности альтернативного сплайсинга пре-мРНК тирозинкиназы в нормальных клетках пока нет. Однако при некоторых типах лейкоза обнаруживаются неправильно сплайсированные мРНК, на которых синтезируются молекулы тирозинкиназы Брутона, лишённые киназной активности.
Отсутствие функциональной формы тирозинкиназы у больных агаммаглобулинемией приводит к сильному снижению количества В-лимфоцитов и антител в крови. Аналогичные мутации в гене тирозинкиназы у мышей вызывают состояние X-сцепленного иммунодефицита. Его проявления менее выражены, чем у людей, например, количество периферических В-лимфоцитов снижено всего вдвое.
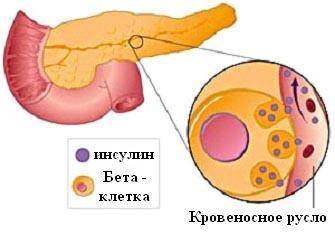
Механизм действия инсулина
 Клетки мишени инсулина это пункты действия гормона. Инсулин способствует хранению и накоплению жиров и глюкозы, которые выступают источниками энергии, внутри клеток. Гормон положительно воздействует на метаболические процессы в тканях, стимулируя рост клеток.
Клетки мишени инсулина это пункты действия гормона. Инсулин способствует хранению и накоплению жиров и глюкозы, которые выступают источниками энергии, внутри клеток. Гормон положительно воздействует на метаболические процессы в тканях, стимулируя рост клеток.
Печень это основной орган, куда попадает инсулин. В этом органе усиливается депонирование глюкозы, которое состоит в ее накоплении в виде гликогена. Внутри печени утилизируется 80% инсулина, который синтезируется поджелудочной железой человека. Остальное количество инсулина поступает в кровоток, а далее в почки.
Как известно, жир выступает самым лучшим способом хранения энергии в человеческом организме. Его формирование из глюкозы также стимулирует гормон инсулин. Им создаются своеобразные энергетические жировые районы. В среднем в мужском организме с весом 70 кг есть около 13 кг жира. Основная доля этого жира находится в жировой ткани.
Инсулин снижает концентрацию жирных свободных кислот в крови, а также способствует накоплению в жировых клетках-мишенях триглицеридов.
Инсулин выполняет свое действие через белок-рецептор. Этот рецептор является сложным интегральным белком клеточной мембраны, который создан из двух субъединиц (a и b). Каждая из них сформирована двумя полипептидными цепочками.
Высокоспецифичный инсулин связывается а-субъединицей рецептора, она при присоединении гормона изменяет свои особенности. Таким образом, возникает тирозинкиназная активность у субъединицы b, это стимулирует разветвленные реакции по активации ферментов.
Вся биохимия последствий взаимодействий инсулина и рецептора еще до конца не ясна, но известно, что возникает появление вторичных посредников, а именно, диацилглицеролов и инозитолтрифосфата. Основной эффект — активация фермента протеинкиназы С с фосфорилирующим действием. С этим связываются изменения в обмене веществ внутри клеток.
Примечания
- ↑
- ↑
- ↑
- ↑
- ↑
Болезнь Бруто́на (син. агаммаглобулинемия, X-сцепленная инфантильная, врожденная агаммаглобулинемия) — вариант первичного гуморального иммунодефицита, вызванный мутациями в гене, кодирующем тирозинкиназу Брутона. Заболевание характеризуется нарушением созревания В-лимфоцитов и почти полным отсутствием плазмоцитов и иммуноглобулинов.
Ибрутиниб (Imbruvica, PCI-32765) — противоопухолевое средство, предназначенное для лечения злокачественных B-лимфопролиферативных заболеваний. Препарат представляет собой ковалентный селективный ингибитор тирозинкиназы Брутона, которая играет важную роль в поддержании жизнеспособности злокачественных клеток.
Препарат был одобрен в США для лечения мантийноклеточной лимфомы (МКЛ), хронического лимфоцитарного лейкоза (ХЛЛ) и макроглобулинемии Вальденстрёма. Ведутся клинические испытания ибрутиниба для лечения прочих B-лимфопролиферативных заболеваний, таких как диффузная B-крупноклеточная лимфома и миеломная болезнь.
Киназы семейства Tec (англ. Tec family kinases, TFKs) — второе по численности семейство цитоплазматических тирозинкиназ млекопитающих. В состав семейства входят пять протеинкиназ: Tec (англ. tyrosine kinase expressed in hepatocellular carcinoma), тирозинкиназа Брутона (Btk), Itk (англ. interleukin 2-inducible T-cell kinase), Bmx (англ. bone marrow tyrosine kinase gene in chromosome X protein) и Rlk/Txk (англ. resting lymphocyte kinase). Большинство киназ этого семейства синтезируются в клетках костномозгового происхождения, за исключением Bmx, которая локализуется главным образом в эндотелиальных клетках. Киназы Tec-семейства играют важную роль в дифференцировке гематопоэтических клеток, воспалении и деструкции кости. Функции отдельных киназ этого семейства, предположительно, могут перекрываться.
Мантийноклеточная лимфома (МКЛ, англ. Mantle Cell Lymphoma, MCL) является уникальным подвидом неходжкинской лимфомы (НХЛ, англ. Non-Hodgkin’s Lymphoma, NHL). Для неё весьма характерна хромосомная транслокация t(11;14)(q13;q32) и гиперэкспрессия ядерного белка циклин D1.
Большинство пациентов с МКЛ попадают в поле зрения врачей уже в продвинутой стадии заболевания (англ. advanced stage disease). Часто наблюдается экстранодальное (внеузловое) поражение (англ. extranodal disease), то есть распространение МКЛ за пределы лимфатической системы. В соответствии с имеющимися у каждого конкретного пациента клиническими и биологическими факторами риска, МКЛ может иметь либо медленное, но неуклонно прогрессирующее (индолентное), либо, наоборот, агрессивное, бурное течение. На сегодняшний день для МКЛ практически не существует лечения, способного привести к радикальному излечению (полному исчезновению всех клеток МКЛ из организма и отсутствию последующих рецидивов болезни), а не просто к временным ремиссиям, за которыми следуют рецидивы. Единственным исключением из этого правила является аллогенная трансплантация гемопоэтических стволовых клеток. Этот метод действительно способен радикально излечить МКЛ (хотя и не во всех случаях) и дать шанс на отсутствие рецидивов. Однако современные схемы иммунохимиотерапии с последующей консолидацией при помощи высокодозной химиотерапии и аутологичной трансплантации стволовых гемопоэтических клеток у молодых пациентов, появление всё большего количества эффективных альтернативных схем иммунохимиотерапии для последовательного применения при очередных рецидивах МКЛ или при резистентности к терапии первой линии, появление новых таргетных препаратов для лечения МКЛ и развитие стратегий поддерживающей терапии привели к улучшению показателей общей и безрецидивной выживаемости. Медиана выживаемости больных со впервые диагностированным МКЛ за последние годы увеличилась с 3 до 6 лет.
Тирозинкиназа:
Тирозинкиназа — фермент подкласса протеинкиназ, группы киназ (фосфотрасфераз).
Тирозинкиназа Брутона — нерецепторная тирозинкиназа Tec-семейства протеинкиназ.
Фармакологические эффекты инсулина
Инсулин оказывает влияние практически на все органы и ткани. Однако его главными мишенями служат печень, мышечная и жировая ткань.
Эндогенный инсулин — важнейший регулятор углеводного обмена, экзогенный — специфическое сахаропонижающее средство. Влияние инсулина на углеводный обмен связано с тем, что он усиливает транспорт глюкозы через клеточную мембрану и её утилизацию тканями, способствует превращению глюкозы в гликоген в печени. Инсулин, кроме того, угнетает эндогенную продукцию глюкозы за счёт подавления гликогенолиза (расщепление гликогена до глюкозы) и глюконеогенеза (синтез глюкозы из неуглеводных источников — например из аминокислот, жирных кислот). Помимо гипогликемического, инсулин оказывает ряд других эффектов.
Влияние инсулина на жировой обмен проявляется в угнетении липолиза, что приводит к снижению поступления свободных жирных кислот в кровоток. Инсулин препятствует образованию кетоновых тел в организме. Инсулин усиливает синтез жирных кислот и их последующую эстерификацию.
Инсулин участвует в метаболизме белков: увеличивает транспорт аминокислот через клеточную мембрану, стимулирует синтез пептидов, уменьшает расход тканями белка, тормозит превращение аминокислот в кетокислоты.
Действие инсулина сопровождается активацией или ингибированием ряда ферментов: стимулируются гликогенсинтетаза, пируват-дегидрогеназа, гексокиназа, ингибируются липазы (и гидролизующая липиды жировой ткани, и липопротеин-липаза, уменьшающая «помутнение» сыворотки крови после приёма богатой жирами пищи).
В физиологической регуляции биосинтеза и секреции инсулина поджелудочной железой главную роль играет концентрация глюкозы в крови: при повышении её содержания секреция инсулина усиливается, при снижении — замедляется. На секрецию инсулина, кроме глюкозы, оказывают влияние электролиты (особенно ионы кальция), аминокислоты (в том числе, лейцин и аргинин), глюкагон, соматостатин.
Структура
Димер, сформированный фрагментами тирозинкиназы Брутона (2—170 а. о.). Фрагмент включает PH-домен и Btk-мотив
Тирозинкиназа Брутона человека состоит из 659 аминокислотных остатков и имеет молекулярную массу около 77 кДа. В белке выделяют следующие домены, начиная с N-конца: PH-домен (домен, гомологичный плекстрину), TH-домен (домен, гомологичный Tec; состоит из Btk-мотива и полипролинового региона), SH2-домен, SH3-домен и каталитический киназный домен.
PH-домен тирозинкиназы Брутона имеет характерную укладку и состоит из сильно изогнутого семитяжевого антипараллельного β-листа и С-концевой α-спирали. PH-домен связывает фосфатидилинозитолфосфаты цитоплазматической мембраны. Мутации в PH-домене, ассоциированные с болезнью Брутона, затрагивают аминокислотные остатки, непосредственно вовлечённые в связывание субстрата.
Btk-мотив соединён с С-концевой частью PH-домена линкером из 7—8 аминокислотных остатков. Глобулярное ядро Btk-мотива уложено напротив β-тяжей 5 и 7 PH-домена. В целом Btk-мотив представляет собой длинную петлю, которая складывается сама на себя и удерживается в таком положении за счёт иона цинка, формирующего координационные связи с остатками гистидина и цистеина. Ион цинка необходим для оптимальной активности и стабильности фермента. Одна из мутаций фермента, ассоциированных с болезнью Брутона, затрагивает один из цинксвязывающих остатков цистеина.
SH2-домен обеспечивает узнавание и связывание фосфотирозинсодержащих пептидов. SH3-домен связывает пролинбогатые участки других белков.
Фармакокинетика препаратов инсулина
Препараты инсулина вводят подкожно, внутримышечно или внутривенно (внутривенно вводят только инсулины короткого действия и только при диабетической прекоме и коме). Нельзя вводить внутривенно суспензии инсулина. Температура вводимого инсулина должна соответствовать комнатной, так как холодный инсулин всасывается медленнее. Наиболее оптимальным способом для постоянной инсулинотерапии в клинической практике является подкожное введение.
Полнота всасывания и начало эффекта инсулина зависят от места введения (обычно инсулин вводят в область живота, бедра, ягодицы, верхнюю часть рук), дозы (объёма вводимого инсулина), концентрации инсулина в препарате и другие.
Скорость всасывания инсулина в кровь из места подкожного введения зависит от ряда факторов — типа инсулина, места инъекции, скорости местного кровотока, местной мышечной активности, количества вводимого инсулина (в одно место рекомендуется вводить не более 12-16 ЕД (единицы действия) препарата). Быстрее всего инсулин поступает в кровь из подкожной клетчатки передней брюшной стенки, медленнее — из области плеча, передней поверхности бедра и ещё медленнее — из подлопаточной области и ягодицы. Это связано со степенью васкуляризации подкожной жировой клетчатки перечисленных областей. Профиль действия инсулина подвержен значительным колебаниям как у различных людей, так и у одного и того же человека.
В крови инсулин связывается с альфа- и бета-глобулинами, в норме — 5-25%, но связывание может возрастать при лечении из-за появления сывороточных антител (выработка антител к экзогенному инсулину приводит к инсулинорезистентности; при использовании современных высокоочищенных препаратов инсулинорезистентность возникает редко). T1/2 (полупериод существования) из крови составляет менее 10 мин. Большая часть поступившего в кровоток инсулина подвергается протеолитическому распаду в печени и почках. Быстро выводится из организма почками (60%) и печенью (40%); менее 1,5% выводится с мочой в неизмененном виде.
Препараты инсулина, применяемые в настоящее время, отличаются по ряду признаков, в том числе по источнику происхождения, длительности действия, pH (среда) раствора (кислые и нейтральные), наличием консервантов (фенол, крезол, фенол-крезол, метилпарабен), концентрацией инсулина — 40, 80, 100, 200, 500 ЕД/мл.
Причины сахарного диабета
Недостаточный синтез инсулина
Развитие ИЗСД (СД 1 типа) обусловлено недостаточным синтезом инсулина в β-клетках островков Лангерганса поджелудочной железы. Среди причин этого в настоящее время на первый план выдвигаются аутоиммунные поражения и инфицирование β-тропными вирусами (вирусы Коксаки, Эпштейна-Бар, эпидемического паротита).

Причины инсулинзависимого сахарного диабета
Помним, что проницаемость стенки кишечника у младенцев выше, чем у взрослых, и это позволяет в первые дни и месяцы жизни сформировать у него пассивный иммунитет за счет перехода антител матери в кровь ребенка.
В связи с этим при использовании коровьего молока или молочных смесей для вскармливания младенцев имеется риск развития ИЗСД из-за возможного развития иммунного ответа на молочный альбумин и переключения иммунной атаки на β-клетки поджелудочной железы.
Происходит это в результате того, что некоторые пептидные участки альбумина коровьего молока и человеческого инсулина схожи между собой. Поэтому при проникновении их через кишечный барьер у детей-носителей антигенов главного комплекса гистосовместимости D3/D4 может возникнуть перекрестная иммунная реактивность и, как следствие, аутоиммунный ответ против собственных β-клеток, что приводит к инсулинзависимому сахарному диабету.
Нечувствительность клеток к инсулину
Для ИНЗСД (СД 2 типа) ведущей причиной является инсулинорезистентность из-за снижения чувствительности клеток-мишеней к гормону. Здесь выделяют две глобальные причины:
- снижение активности рецепторов (рецепторные механизмы),
- нарушение проведения сигнала от рецептора к внутриклеточным ферментам (пострецепторные механизмы).
Рецепторные механизмы
Функциональные нарушения рецепторов — замедляют связывание инсулина и ответ на него:
- увеличение диаметра и площади поверхности жировых клеток (ожирение) — снижение скорости образования рецепторных микроагрегатов,
- повышенная вязкость мембран (снижение доли ненасыщенных жирных кислот в фосфолипидах, увеличение содержания холестерина),
- блокирование инсулиновых рецепторов антителами,
- нарушение мембран в результате активации процесов ПОЛ.
Структурные нарушения рецепторов — не позволяют связываться с гормоном или отвечать на его сигнал.
изменение конформации рецепторов инсулина при воздействии свободных радикалов (продуктов окислительного стресса).
Пострецепторные механизмы
Пострецепторные механизмы сопровождаются ослаблением проведения сигнала через .
В настоящее время ослабление проведения сигнала через IRS-ФИ-3-киназный путь считают главной причиной инсулинорезистентности.
В результате развиваются снижение активации белков этого сигнального пути, отсутствие быстрых эффектов инсулина — активация трансмембранных переносчиков глюкозы (ГлюТ4) и метаболических ферментов утилизации глюкозы.
Предложено два механизма нарушения ФИ-3-киназного пути:
- Фосфорилирование серина (но не тирозина) в составе IRS уменьшает его способность связываться с ФИ-3-киназой и ослабляет ее активирование. Данный процесс катализируется множеством серин-треониновых киназ, активность которых повышается при воспалении, стрессе, гиперлипидемиях, ожирении, переедании, дисфункции митохондрий.
- Нарушение баланса между количеством субъединиц ФИ-3-киназы (p85 и p110), т.к. эти субъединицы могут конкурировать за одни и те же участки связывания с белком IRS. Этот дисбаланс меняет активность фермента и снижает передачу сигнала. Причиной патологического повышения отношения p85/p110 предполагают высококалорийное питание.
Развивающуюся при беременности инсулинорезистентность связывают с увеличенной экспрессией в клетках скелетных мышц субъединицы p85, вызванной повышением концентрации человеческого плацентарного гормона роста. Соответственно, изменяется соотношение p85/p110 и ухудшается развертывание быстрых эффектов инсулина.

Причины развития инсулиннезависимого сахарного диабета
- В начало
- Назад
- 1
- Вперёд
- В конец
Ингибиторы
Структура ибрутиниба
Понимание особой роли тирозинкиназы Брутона в патогенезе некоторых заболеваний привело к созданию ингибиторов её киназной активности с целью терапевтического применения. Одним из первых был разработан обратимый ингибитор киназ семейства Tec LFM-A13, который связывается с каталитической полостью тирозинкиназы, определяемой остатками Leu-460, Tyr-476, Arg-525 и Asp-539. LFM-A13 ингибирует BTK в условиях in vitro c IC50=7,5 микромоль/литр. К 2013 году данных о клинической активности LFM-A13 получено не было.
К 2013 году были получены и другие обратимые ингибиторы BTK: ONO-WG-307, GDC-0834 и дазатиниб. ONO-WG-307 блокирует автофосфорилировние BTK по положению Tyr-223 с IC50=2 наномоль/литр. В доклинических испытаниях этот ингибитор показал эффективность в отношении диффузной B-крупноклеточной лимфомы подтипа ABC, фолликулярной лимфомы и хронического лимфолейкоза.
Дазатиниб был разработан как ингибитор тирозинкиназной активности BCR-ABL1 и применяется для лечения хронического миелобластного лейкоза и острого B-клеточного лимфобластного лейкоза, характеризующихся наличием химерного онкогена BCR-ABL1. Однако выяснилось, что он также обратимо ингибирует тирозинкинзу Брутона с IC50=5 наномоль/литр. Дазатиниб был протестирован в клиническом исследовании II фазы на пациентах с рецидивирующим или устойчивым хроническим лимфолейкозом. В 20 % случаев был получен ответ на препарат, однако также были отмечены и частые серьёзные побочные эффекты.
Вторую группу ингибиторов BTK составляют ковалентные необратимые ингибиторы, такие как ибрутиниб (PCI-32765) и AVL-292 (CC-292). Обе молекулы образуют ковалентную связь с Cys-481 в активном сайте киназы. Эти ингибиторы характеризуются большей специфичностью в отношении тирозинкинзы Брутона и IC50=0,5 наномоль/литр.
Распространение и внутриклеточная локализация
Тирозинкиназа Брутона характерна для В-лимфоцитов на разных стадиях их развития: в развивающихся клетках в костном мозге содержится больше всего белка, с выходом клеток в кровь его количество снижается, а в плазматических клетках фермент уже не обнаруживается. Кроме того, тирозинкиназа Брутона присутствует и в других клетках костномозгового происхождения: моноцитах/макрофагах, тучных клетках, нейтрофилах, эритробластах, тромбоцитах, дендритных клетках и остеокластах. Однако в Т-лимфоцитах эта киназа, по всей видимости, не синтезируется. Тирозинкиназа Брутона играет более важную роль в судьбе В-лимфоцитов, чем любых других клеток. Это подтверждается тем, что мутации в гене фермента при болезни Брутона затрагивают в первую очередь созревание именно этих клеток. В клетках других типов функции тирозинкиназы, по всей видимости, дублируются другими ферментами.
Белки, тирозинкиназе Брутона млекопитающих, обнаружены также у птиц, рыб и насекомых. Однако несмотря на эволюционную консервативность аминокислотной последовательности этих белков, их функции различаются в разных группах организмов. Например, у дрозофилы гомолог тирозинкиназы важен для развития гениталий самцов, в то время как у млекопитающих этот фермент участвует в развитии и функционировании клеток иммунной системы.
Тирозинкиназа Брутона локализуется, главным образом, в цитоплазме клетки. При активации фермент перемещается в плазматическую мембрану за счёт взаимодействия PH-домена (см. ниже) с её компонентами. Небольшое количество белка обнаруживается также в клеточном ядре, это позволяет предполагать, что тирозинкиназа циркулирует между ядром и цитоплазмой. Известно, что фермента их ядра обеспечивает экспортин Crm1.
Функция
Ген TYK2 кодирует члена белкового семейства тирозинкиназы, точнее, семейства янускиназ (JAK). Этот белок связывается с цитоплазматическим доменом рецепторов цитокинов типа I и типа II и распространяет сигналы цитокинов посредством фосфорилирования рецепторных субъединиц цитокинов. Он также является компонентом сигнальных путей интерферона как типа I, так и типа III. Как таковая, тирозинкиназа 2 может играть определенную роль в антивирусном иммунитете.
В семейство JAK у млекопитающих входят четыре члена: JAK1, JAK2, JAK3 и тирозинкиназа 2 (Tyk2). Связь между белками JAK и сигнальными путями цитокинов впервые была выявлена, когда изучение генов, вовлечённых в сигнальные пути (IFN-I), показало, что их необходимым элементом является Tyk2, активируемая . Tyk2 имеет более широкие и глубокие функции в организме человека, чем ранее предполагалось на основе анализа мышиных моделей, которые показывали, что функции Tyk2 в первую очередь состояли в сигнальных путях и IFN-I. Дефицит Tyk2 имеет более острые последствия в клетках человека, чем в клетках мыши. Тем не менее, в дополнение к и сигнализации , Tyk2 играет важнейшую роль в сигнальных путях , и IL-6. Так, Tyk2 может оказывать влияние на на сигналы IL-6, передаваемые через цепь рецепторов , которая является общей для большого семейства цитокинов, в числе которых IL-6, IL-11, , , (OSM), , , и . Недавно было показано, что IL-12 и IL-23 имеют общие лиганды и рецепторные субъединицы, которые активируют Tyk2. IL-10 является критическим противовоспалительным цитокином, и мыши с дефицитом IL-10 страдают от фатальных системных аутоиммунных заболеваний.
Tyk2 активируется IL-10, и дефицит тирозинкиназы 2 влияет на способность реагировать на сигналы IL-10. В физиологических условиях иммунные клетки, в общем, регулируются действием многих цитокинов, и представляется ясным, что перекрестные помехи между сигнальными путями различных цитокинов участвуют в регуляции .
Роль в воспалительных процессах
В настоящее время широко признано, что атеросклероз является результатом клеточных и молекулярных событий воспалительного характера. Воспаление сосудов может быть вызвано усилением активности ангиотензина II, который производится локально воспаленными сосудами и индуцирует синтез и секрецию IL-6 — цитокина, отвечающего за индукцию синтеза ангиотензиногена в печени через JAK/STAT3-путь, который активируется через мембранные рецепторы с высоким сродством на целевых клетках. Эти рецепторы называются -цепью рекрутирования , эта цепь связана с тирозинкиназами (Jak 1/2 и Tyk2). Цитокины IL-4 и повышены в лёгких у лиц, хронически страдающих астмой. Сигнализация через IL-4/IL-13 комплексы, как полагают, проходит через -цепи, которые отвечают за активацию киназ JAK-1 и Tyk2. Роль Tyk2 при ревматоидном артрите непосредственно проявляется у Tyk2-дефицитных мышей, которые были устойчивы к артриту. Дефицит Tyk2 мышей отражается на отсутствии реакции к небольшим количеством IFN-α, но они обычно реагируют на высокие концентрации IFN-α/β
Кроме того, эти мыши нормально реагируют на IL-6 и IL-10, предполагается, что Tyk2 несущественна для передачи сигналов IL-6 и IL-10 и не играет важной роли в IFN-α сигнализации. Хотя мыши с дефицитом Tyk2 фенотипически нормальны, они демонстрируют аномальные ответы на воспалительные процессы в различных клетках
Самый интересный фенотип наблюдался у Tyk2-дефицитных макрофагов: происходило уменьшение продукции оксида азота при стимуляции липополисахаридами (LPS). Кроме того, выяснение молекулярных механизмов передачи сигналов LPS показали, что у мышей дефицит Tyk2 и IFN-β обусловливает сопротивляемость к LPS-индуцированному эндотоксиновому шоку, в то время как мыши с дефицитом STAT1 — восприимчивы. Разработка ингибитора Tyk2 кажется рациональным подходом для создания медикаментов.
Список источников
- diabetik.guru
- StudFiles.net
- wiki2.org
- wiki.sc
- ruwikiorg.ru
- studbooks.net
- howlingpixel.com
- biokhimija.ru
- www.muldyr.ru
- wikiredia.ru
- ru.wikibedia.ru