Глава 7 Физиология сократительных элементов.
Двигательные функции, осуществляемые
сократительными элементами мышечных
тканей (поперечнополосатое скелетное
МВ, кардиомиоциты, ГМК) и немышечными
контрактильными клетками (миоэпителиальные,
миофибробласты и др.), обеспечивает
актомиозиновыйхемомеханическийпреобразователь. В скелетных МВ и
кардиомиоцитах присутствуют сократительные
единицы — саркомеры, этопоперечнополоcатыемышцы, в ГМК саркомеров нет, этогладкиемышцы. Сократительную
функцию скелетной мышечной ткани
(произвольнаямускулатура)
контролирует нервная система (соматическая
двигательная иннервация).Непроизвольныемышцы(сердечная и гладкая) имеют
вегетативную двигательную иннервацию,
а также развитую систему гуморального
контроля их сократительной активности.
Все мышечные элементы способны к
генерации ПД, распространяющихся по
клеточной мембране (сарколемме).
Строение сарколеммы
Путь: Медицинский блог Андрея Новицкого > Строение сарколеммы
Строение сарколеммы подчинено ее основным функциям, в ней начинается процесс электромеханического сопряжения с последующей мобилизацией всех непосредственно участвующих в нем органелл. В сарколемме различают внутренний слой, плазматическую мембрану (плазмолемма) и глико каликс (базальная мембрана, перимембрана, гликолемма).
Контактные зоны смежных кардиомиоцитов (электронограмма)
Гликокаликс, покрывающий поверхность кар диомиоцита, входит в непосредственный контакт с межклеточным пространством, стенками капилляров, коллагеновыми волокнами. Представляет собой опорно-фибриллярный комплекс сложных липидов, протеогликанов и коллагена IV типа. В гликокаликсе различают поверхностную и более плотную внутреннюю пластинки толщиной 20 и 30 нм. Наличие в гликокаликсе сиаловых кислот и гликозаминогликанов сообщает ему полианионные свойства. Гликокаликс стабилизирует плазмолемму, является основным внеклеточным депо Са2+, участвующего в регуляции сокращения кардиомиоцита. Между ним и плазмолеммой имеется довольно постоянная щель шириной 10 нм.
Плазмолемма представляет собой элементарную трехслойную мембрану толщиной 8 нм. С биофизической точки зрения это микрогетерогенно-динамическая система с жидкокристаллическими свойствами. В плазмолемме выявляются белковые частицы диаметром 7–10 нм, как погруженные в липидный бислой мембраны, так и пересекающие всю ее толщу.
Структура мембраны поддерживается нековалентными, гидрофобными и гидрофильными взаимодействиями белков, липидов и олигосахаридов. Один из основных компонентов мембраны — белки часто совмещают структурную функцию с рецепторной или ферментной, примерами чего являются Na+, К+-АТФаза, комплекс β-адрено рецептор — аденилатциклаза и др. Важнейшая особенность плазмолеммы, обусловленная присутствием белков, — наличие каналов, обеспечивающих медленный, электрогенный и быстрый, электронейтральный транспорт Са2+.
Фиксация сарколеммы свободной поверхности рабочих кардиомиоцитов к миофибриллам на уровне Z-линий об условливает ее фестончатые выбухания при сокращении клетки.
Сарколемма кардиомиоцита имеет пять различных специализированных зон: большие и малые инвагинации, формирующие Т-систему и кавеолы, участки контактов с саркоплазматическим ретикулумом и вставочные диски. Диаметр кавеол — 50–80 нм, они являются динамичными структурами, напоминающими везикулы. Их содержимое — гранулярный или мелкодисперсный матрикс. Количество кавеол увеличивается при нагрузке или при СН.
Т-систему образуют глубокие разветвленные впячивания боковой сарколеммы, выстланные гликокаликсом. Устья Т-тубул находятся на уровне Z-линий. Их начальные отделы, ориентированные перпендикулярно миофибриллам, диаметром 150–200 нм. Т-система образует продольные и поперечные ответвления, постепенно истончается и проникает до границы околоядерного пространства, примерно на треть увеличивая суммарную площадь сарколеммы. Ее тесный контакт с саркоплазматическим ретикулумом обеспечивает проведение электрохимического импульса в аксиальные отделы клетки.
Вставочный диск при световой микроскопии виден как темная линия неодинаковой ширины, проходящая через мышечное волокно. Он образуется сарколеммой двух кардиомиоцитов на уровне Z-линий одного или нескольких саркомеров. В пределах вставочного диска имеются три вида специализированных структур: нексусы, десмосомы и промежуточные соединения.
Эта страница была опубликована 24.01.2011.
Метки: сердце
Миофибриллы
Каждая миофибрилла содержит около 1500
толстых и 3000 тонких нитей. Поперечная
исчерченность скелетного МВ (рис. 7–1)
определяется регулярным чередованием
в миофибриллах различно преломляющих
поляризованный свет участков (дисков) —
изотропных и анизотропных: светлые(Isotropic, I–диски) итёмные(Anisotropic,
А–диски)диски. Разное светопреломление
дисков определяется упорядоченным
расположением по длине саркомера тонких
(актиновых) и толстых (миозиновых) нитей:толстыенитинаходятся только
в тёмных дисках,светлыедискине содержат толстых нитей. Каждый светлый
диск пересекаетZ—линия. Участок
миофибриллы между соседними Z-линиями
определяют каксаркомер.
Саркомер— часть миофибриллы,
расположенная между двумя последовательными
Z–дисками. В состоянии покоя и полностью
растянутой мышце длина саркомера
составляет 2 мкм. При такой длине
саркомера актиновые (тонкие) нити лишь
частично перекрывают миозиновые
(толстые) нити. Один конец тонкой нити
прикреплён к Z-линии, а другой конец
направлен к середине сaркомера. Толстые
нити занимают центральную часть
сaркомера — А–диск (содержащий только
толстые нити участок сaркомера —
Н-зона, в середине Н-зоны проходит
М-линия). I–диск входит в состав двух
сaркомеров. Следовательно, каждый
сaркомер содержит один А–диск (тёмный)
и две половины I–диска (светлого), формула
саркомера — 0,5А + I + 0,5А. Во время
сокращения длина A–диска не меняется,
а I–диска — укорачивается, что и
послужило основанием для создания
теории, объясняющей сокращение мышцы
механизмом скольжения (теорияскольжения) тонких актиновых нитей
вдоль толстых миозиновых.
Толстаянить(рис 7–3Б).
Каждая миозиновая нить состоит из
300–400 молекул миозина и С‑белка.Миозин(рис 7–3В) — гексaмер (две
тяжёлые и четыре лёгкие цепи). Тяжёлые
цепи — две спирально закрученные
полипептидные нити, несущие на своих
концах глобулярные головки. В области
головок с тяжёлыми цепями ассоциированы
лёгкие цепи. Каждую миозиновую нить
связывает с Z–линией гигантский белок
титин. С толстыми нитями ассоциированы
небулин, миомезин, креатинфосфокиназа
и другие белки.
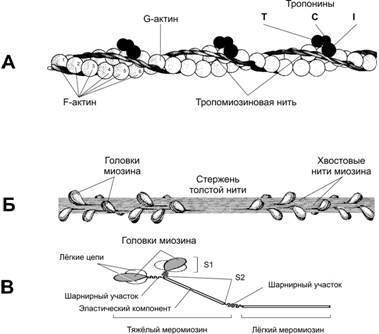
Рис.7-3.Тонкаяитолстаянитивсоставемиофибрилл.А.Тонкаянить— две
спирально скрученные нити фибриллярного
актина (F‑актин). В канавках спиральной
цепочки залегает двойная спираль
тропомиозина, вдоль которой располагаются
молекулы тропонина трёх типов.Б—толстаянить. Молекулы миозина
способны к самосборке и формируют
веретенообразный агрегат диаметром 15
нм и длиной 1,5 мкм. Фибриллярные хвосты
молекул образуют стержень толстой нити,
головки миозина расположены спиралями
и выступают над поверхностью толстой
нити.В—молекуламиозина.
Лёгкий меромиозин обеспечивает агрегацию
молекул миозина, тяжёлый меромиозин
имеет связывающие актин участки и
обладает активностью АТФазы.
Миозин(рис.7–3В). В молекуле
миозина (мол. масса 480 000) различают
тяжёлый и лёгкий меромиозин.Тяжёлыймеромиозинсодержитсубфрагменты(S):S1содержит глобулярные
головки миозина,S2—
прилежащую к головкам часть фибриллярногохвостамолекулы миозина. S2эластичен (эластическийкомпонентS2), что допускает отхождение
S1на расстояние до 55 нм. Концевую
часть хвостовой нити миозина длиной
100 нм образуетлёгкиймеромиозин.
Миозин имеет двашарнирныхучастка,
позволяющих молекуле изменять конформацию.
Одиншарнирныйучасток находится
в области соединения тяжёлого и лёгкого
меромиозинов, другой — в областишейкимолекулы миозина (S1—S2–соединение).
Половина молекул миозина обращена
головками к одному концу нити, а вторая
половина — к другому (рис.7–3Б).
Лёгкий меромиозин лежит в толще толстой
нити, тогда как тяжёлый меромиозин
(благодаряшарнирнымучасткам)
выступает над её поверхностью.
Титин— наибольший из
известных полипептидов с мол. массой
3000 кД — наподобие пружины связывает
концы толстых нитей с Z-линией. Другой
гигантский белок —небулин(Mr800 кД) — ассоциирует тонкие и толстые
нити.
С‑белокстабилизирует
структуру миозиновых нитей. Влияя на
агрегацию молекул миозина, обеспечивает
одинаковый диаметр и стандартную длину
толстых нитей.
Миомезин(М‑белок) икреатинфосфокиназа— белки,
ассоциированные с толстыми нитями в
середине тёмного диска. Креатинфосфокиназа
способствует быстрому восстановлению
АТФ при сокращении. Миомезин выполняет
организующую роль при сборке толстых
нитей.
СОТ СТРУКТУРНАЯ ЕДИНИЦА САРКОМЕРА
Национальный государственный Университет физической культуры, спорта и здоровья им. П.Ф. Лесгафта, Санкт-Петербург, кафедра биомеханики
Аннотация
В статье рассмотрена структура саркомера. Предложен новый термин для обозначения структурной единицы саркомера – сот. Введение нового термина позволяет правильно понять состав и пространственную организацию саркомера, дать количественную характеристику саркомерам различных скелетных мышц, выразить площадь поперечного сечения саркомера через площадь поперечного сечения сота и количество сот в саркомере. Введение нового термина позволяет также дать количественную характеристику влияния различных видов физической нагрузки на характеристики саркомера и параметры, определяющие площадь его поперечного сечения.
2.2.3. Миофибриллы организация миофиламентов в саркомере
|
Вышеизложенный в
2222
причём |
I. Телофрагма
и тонкие миофиламенты
|
Тело- |
Телофрагма сетчатая
3333
расположена служит |
|
|
Состав |
а)
4444
б) в) глобулярный и
5555
г) тонкие миофиламенты |
Электронная АБПолный |
|
Роль
6666
|
а) б) в что |
|
|
Крепле- |
а) б) две идущих |
|
|
в) |
||
|
Коли- |
Всего |
II.
Толстые миофиламенты и мезофрагма
|
Состав |
а) б) «стержень» |
|
|
в) их а |
||
|
Креп- |
а) б) в) длина и г) Они |
|
|
Коли- |
Всего вчетверо |
III.
Взаимное расположение миофиламентов
|
Состав |
Из в в а |
|
Гексаго- |
В вокруг |
|
Относи- |
а) б) вчетверо (что |
IV.
Дополнительные
опорные структуры
|
Общий |
Такаяупорядоченность уже а также ещё не |
|
Промежу- |
а) б) соседние телофрагмы а |
|
Костамеры |
Костамеры расположены прикрепляют |

Список источников
- allasamsonova.ru
- StudFiles.net
- essenciale.ru
