Общее уравнение дыхания, баланс атф
|
Стадия
1111
|
Выход |
Выход |
Способ |
|
Первая
2222
|
−2 |
Фосфорилирование |
|
|
Вторая |
4 |
Субстратное |
|
|
2
3333
|
3 |
Окислительное |
|
|
Декарбоксилирование |
2
4444
|
5 |
Окислительное |
|
Цикл |
2 |
Субстратное |
|
|
6
5555
|
15 |
Окислительное |
|
|
2 |
3 |
Окислительное |
|
|
Общий
6666
|
30 |
При |
Энергетический
эффект какого-либо биологического
вещества выражают количеством АТФ,
которое можно получить в данном процессе.
Расчет энергетического эффекта
биохимических процессов, протекающих
в анаэробных и аэробных условиях, следует
производить по-разному.
Расчет
энергетического эффекта гликолиза. Гликолиз
— это анаэробный процесс. При расчете
энергетического эффекта биохимического
процесса в анаэробных условиях следует
учитывать:
-
1)
затраты АТФ (как правило, в фосфотрансферазных
реакциях); -
2)
образование АТФ в процессах субстратного
фосфорилирования.
В
первом этапе гликолиза происходит
затрата 2 моль АТФ: на фосфорилирование
глюкозы и на фосфорилирование
глюкозо-6-фосфата
Еще раз заострим
внимание на том, что из 1 моль глюкозы
образуется 2 моль 3-фосфоглицеринового
альдегида, который вступает во второй
этап гликолиза
Во
втором этапе гликолиза можно найти две
реакции субстратного фосфорилирования,
в которых образуется 2 моль АТФ при
распаде 1 моль 3-фосфоглицеринового
альдегида. Следовательно, при распаде
2 моль 3-фосфоглицеринового альдегида
образуется 4 моль АТФ. Суммируя полученное
и затраченное количество АТФ, получаем
суммарный энергетический
эффект гликолиза —
2 моль
АТФ.
Расчет
энергетического эффекта полного распада
глюкозы в аэробных условиях. При
расчете энергетического эффекта
биохимического процесса в аэробных
условиях следует учитывать:
-
1)
затраты АТФ; -
2)
образование АТФ в процессах субстратного
фосфорилирования; -
3)
фосфорилирование АДФ, сопряженное с
работой электронотранспортной цепи.
Процессы
полного распада глюкозы до оксида
углерода (IV) и воды разделим на этапы и
проведем расчет энергетического эффекта
каждого этапа.
153
-
Первый
этап гликолиза — на этом этапе затрачиваются
2 моль АТФ. -
Второй
этап гликолиза — 4 моль АТФ получаются
в реакциях субстратного фосфорилирования.
Фермент 3-фосфоглицеральде-гидцегидрогеназа
катализирует отщепление 2 атомов
водорода от молекулы субстрата, поставляя
их в электронотранспортную цепь;
результатом сопряжения окисления с
фосфорилированием АДФ является
образование 3 моль АТФ на каждый моль
3-фосфоглицеринового альдегида. Поскольку
из 1 моль глюкозы образуется 2 моль
3-фосфоглицеринового альдегида, в данном
процессе образуется 6 моль АТФ. -
Окислительное
декарбоксилирование ПВК дает 6 моль
АТФ, так как в электронотранспортную
цепь водороды поставляют 2 моль НАД. -
В
цикле Кребса нет затрат АТФ и отсутствуют
реакции субстратного фосфорилирования.
Однако имеются четыре дегидрогеназные
реакции, и в одной реакции образуется
ГГФ, которая по выходу энергии эквивалентна
АТФ.
Выход
АТФ на отдельных стадиях цикла Кребса
суммирован в таблице 9.
Таблица
9
Анаэробное дыхание
Основная
статья:Анаэробное
дыхание
Если
в электронтранспортной цепи вместо
кислорода используется другой конечный
акцептор (трёхвалентное железо, нитрат-
или сульфат-анион),
дыхание называется анаэробным. Анаэробное
дыхание свойственно в основном бактериям,
которые благодаря этому играют важную
роль в биогеохимическом цикле серы,
азота и железа. Денитрификация —
один из типов анаэробного дыхания —
является одним из источников парниковых
газов, железобактерии принимают
участие в образовании железомарганцевых
конкреций.
Среди эукариот анаэробное дыхание
встречается у некоторых грибов, морских
донных беспозвоночных, паразитических
червей и
протистов — например, фораминифер .
Биологическое окисление
Распад веществ в
тканях сопровождается потреблением
кислорода и выделением СО2.
При этом выделяется энергия, необходимая
для функционирования клеток. Вдыхаемый
кислород используется для синтеза
метаболической воды с участием водорода
окисляемых субстратов в процессе
тканевого
дыхания.
SH2
+ ½ О2
S
+ Н2О
+ энергия
Например, окисление
1 моль глюкозы происходит с выделением
2780 кДж энергии. Энергия окисляющихся
веществ используется клетками для
синтеза АТФ из АДФ. Фосфорилирование
АДФ в клетках происходит путем
присоединения Н3РО4.
Реакция идет с затратой энергии.
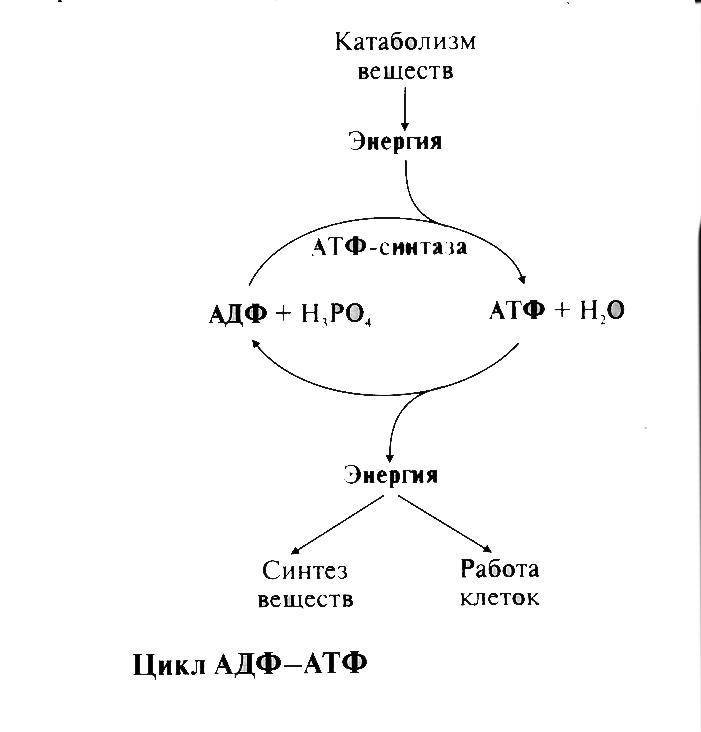
АТФ
— молекула, богатая энергией, поскольку
она содержит две макроэргические связи.
Некоторые биосинтетические реакции в
организме могут протекать при участии
других нуклеозидтрифосфатов, аналогов
АТФ; к ним относят ГТФ, УТФ и ЦТФ. Все эти
нуклеотиды, в свою очередь, образуются
при использовании свободной энергии
концевой фосфатной группы АТФ. Наконец,
за счёт свободной энергии АТФ совершаются
различные виды работы, лежащие в основе
жизнедеятельности организма, например,
такие как мышечное сокращение или
активный транспорт веществ.
При использовании
АТФ в качестве источника энергии чаще
всего происходит гидролиз только одной
макроэргической связи, при этом выделяется
около 50 кДж/моль энергии и опять образуется
АДФ. Содержание АТФ в организме человека
невелико и составляет около 50 г. учитывая,
что клетки не способны накапливать АТФ,
а расход энергии происходит постоянно,
в организме также постоянно идет синтез
АТФ из АДФ и неорганического фосфата
Н3РО4.
За сутки в организме человека может
синтезироваться до 60 кг АТФ.
В зависимости от
источника энергии, обеспечивающего
присоединение фосфатного остатка,
выделяют два типа фосфорилирования
АДФ: окислительное и субстратное.
Субстратное
фосфорилирование АДФ
идет за счет энергии макроэргических
связей соединений (1,3-бисфосфоглицерата
и фосфоенолпирувата, сукцинил-СоА). Этот
процесс может происходить как в матриксе
митохондрий, так и в цитоплазме клеток
независимо от присутствия кислорода.
Окислительное
фосфорилирование АДФ
— превращение АДФ в АТФ происходит с
использованием энергии переноса
электронов от органических веществ к
кислороду. Энергию для окислительного
фосфорилирования поставляют ОВР. Процесс
может происходить только в аэробных
условиях с участием ферментов цепи
переноса электронов (ЦПЭ) и АТФ-синтазы.
Окислительное
фосфорилирование АДФ – основной
механизм синтеза АТФ в организме. Оно
происходит в митохондриях, которые
являются основными поставщиками АТФ и
могут рассматриваться как «энергетические
станции» клетки.
Мембраны митохондрий
сильно различаются по составу и функциям.
Внешняя мембрана свободно проницаема
для многих небольших молекул до 5000кДа.
Проницаемость внутренней мембраны
ограничена и определяется наличием
белков-переносчиков. Внутренняя мембрана
митохондрии богата белками (80%). В нее
включены все ферментные комплексы и
компоненты ЦПЭ, отвечающей за окислительное
фосфорилирование АДФ.
Одним из самых
крупных белков внутренней мембраны
митохондрий является АТФ-синтаза.

Это белок, состоящий
из двух олигомерных комплексов (F
и F1).
Fсостоит из
6 гидрофобных протомеров типа a,
b,
c,
погруженных во внутреннюю мембрану
митохондрий и формирующих Н+-
проводящий канал. 3 дополнительные
субъединицы связывают комплекс Fс комплексом
F1.
Комплекс F1
выступает
в матриксе митохондрии и образует
«пузырек» на внутренней поверхности
мембраны митохондрии, имеющий активный
центр для связывания АДФ иН3РО4.
В нем происходит фосфорилирование и
образование АТФ.
Межмембранное
пространство также играет роль в
производстве АТФ, так как может накапливать
протоны, создающие заряд на поверхности
внутренней мембраны, необходимый для
активации АТФ-синтазы.
Матрикс митохондрий
состоит из ферментов, ДНК, РНК и рибосом.
ОВР в клетке происходят в матриксе
митохондрий. Важнейшими источниками
энергии служат реакции дегидрирования.
В реакциях дегидрирования электроны и
протоны переходят от органических
субстратов на коферменты NAD- и FAD-зависимых
дегидрогеназ. Электроны, обладающие
высоким энергетическим потенциалом,
передаются от восстановленных коферментов
NADH и FADH2
к кислороду через цепь переносчиков,
локализованных во внутренней мембране
митохондрий. Восстановление молекулы
О2
происходит в результате переноса 4
электронов. При каждом присоединении
к кислороду 2 электронов, поступающих
к нему по цепи переносчиков, из матрикса
поглощаются 2 протона, в результате чего
образуется молекула Н2О.
Фосфорилирование белков
Обратимое фосфорилирование боковых цепей — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков . Считается, что фосфорилированию подвержено около трети всех белков .
О существовании фосфопротеинов было известно уже в конце XIX века. В то время считалось, что их функция — аккумуляция питательных веществ, так как фосфоказеин был обнаружен в молоке, а фосфовитины — в яичном желтке. Только в 50-х годах XX века стало понятно, что фосфопротеины распространены повсеместно. В в эксперименте по фосфорилированию гомогенатом из клеток печени крысы было показано, что фосфорилирование белков имеет ферментативный характер. Исторически первым было открыто фосфорилирование белков по остаткам , затем стало известно фосфорилирование по остаткам . Первая тирозиновая киназа была открыта в 1980 году, это был вируса саркомы Рауса.
Под реакцией фосфорилирования белка понимают присоединение фосфатной группы через фосфоэфирную связь (О-фосфорилирование) к гидроксильной группе боковой цепи остатка , или , донором фосфата при этом является . В подавляющем большинстве случаев фосфорилирование происходит именно по этим трём аминокислотным остаткам. Однако в природе встречается также фосфорилирование по остаткам и (N-фосфорилирование), и (A-фосфорилирование). Образующиеся при фосфорилировании эфиры фосфорной кислоты весьма стабильны, поэтому для их разрушения необходимы специальные ферменты – . Это создаёт основания для тонкой регуляции уровня фосфорилированности белка с помощью контроля за уровнем соответствующих протеинкиназ и протеинфосфатаз.
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
Список источников
- StudFiles.net
- howlingpixel.com
