В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
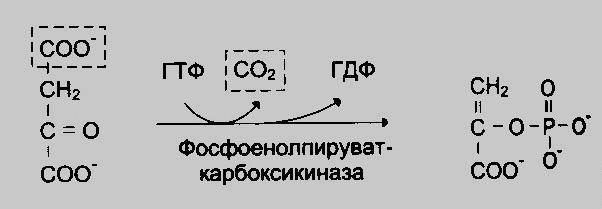
После
образования фосфоенолпирувата процесс
глюконеогенеза идет по обратимым
реакциям гликолиза, вплоть до синтеза
фруктозо-1,6-бисфосфата. Превращение
фруктозо-1,6-бисфосфата во фруктозо-6-фосфат
– необратимая реакция глюконеогенеза,
а потому отщепление фосфатной группы
катализируется фруктозо-1,6-фосфатазой:

Данная
реакция протекает без участия АТР и
АDP.
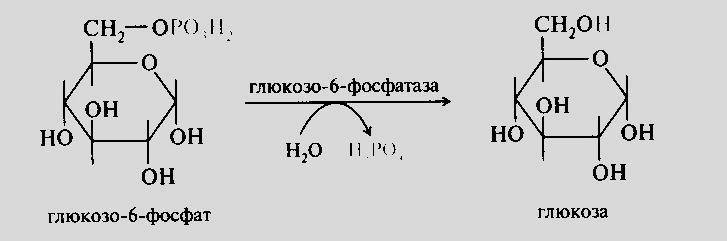
Образовавшийся
фруктозо-6-фосфат фосфоглюкоизомеразой
переводится в глюкозо-6-фосфат, который
под действием глюкозо-6-фосфатазы (в
процессе гликолиза этот фермент не
участвует, и это еще одна необатимая
реакция глюконеогенеза) теряет фосфатную
группу и превращается в свободную
глюкозу. После чего глюкоза транспортитуется
в кровь.
Суммарный
результат глюконеогенеза из пирувата
выражается следующим уравнением:
2 пируват + 4АТР +
2GTP
+ 2NADH
+2H+
+ 4Н2О
→ Глюкоза + 4ADP
+ 2GDP
+ 6Н3РО4
+ 2NAD+
Регуляторным
ферментом в глюконеогенезе является
пируваткарбоксилаза, которая активируется
ацетил-CоА
тогда, когда в митохондриях накапливается
больше данного субстрата, чем требуется
для протекания цикла трикарбоновых
кислот.
Одновременно
ацетил-СоА ингибирует пируватдегидрогеназный
комплекс, что приводит к замедлению
окисления пирувата и способствует
вовлечению его в глюконеогенез.
Немаловажную
роль в регуляции глюконеогенеза играет
фруктозо-1,6-бисфосфатаза, ингибируемая
АМР. При высоком соотношении АТР/АМР
активируется глюконеогенез и ингибируется
гликолиз, т. к. АТР является ингибитором
лимитирующего фермента гликолиза –
фосфофруктокиназы.
В последнее время
установлено, что наиболее мощным
аллостеричеким регулятором является
фруктозо-2,6-бисфосфат. Это бисфосфорное
производное фруктозы ингибирует
фруктозо-1,6-бисфосфатазу и активирует
фосфофруктокиназу.
Синтез глюкозы из
лактата и преврашение его в пируват
есть способ утилизации лактата, который
накапливается в интенсивно сокращающихся
мышцах или клетках с преобладанием
анаэробного катаболизма глюкозы.
Лактат из мышц
поступает в кровь, затем – в печень. В
печени соотношение NADH/NAD+
ниже, чем в работающей мышце, поэтому
лактатдегидрогеназа работает в
направлении образования пирувата,
включающегося в глюконеогенез.
Образовавшаяся глюкоза из печени
поступает в кровь и затем в мышцу.
Вышеизложенная
последовательность событий называется
«глюкозо-лактатным циклом», или «циклом
Кори», выполняющим функции утилизации
лактата и предотвращения лактоацидозов

Рис. 20.2. Цикл Кори
(глюкоза-лактатный цикл): 1 ‒
поступление лактата из сокращающейся
мышцы с током крови в печень; 2 – синтез
глюкозы из лактата в печени; 3 – поступление
глюкозы из печени с током крови в
работающую мышцу; 4 – использование
глюкозы как энергетического субстрата
сокращающейся мышцей и образование
лактата
Термин «лактоацидоз»
обозначает увеличение кислотности
среды организма до значений, выходящих
за пределы нормы. При ацидозе либо
увеличивается продукция протонов или
происходит снижение их экскреции. А в
некоторых случаях и то и другое.
Пируваткарбоксилаза
|
Гликолиз и глюконеогенез. |
Важным моментом в регуляции глюконеогенеза является реакция, катализируемая пируваткарбоксилазой. В отсутствие ацетил — КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил — КоА, биосинтез глюкозы из пирувата усиливается. Следовательно, накопление ацетил — КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу.
Первый этап в этой обходной последовательности реакций катализируется мито-хондриальной пируваткарбоксилазой. Этот биотинсодержащий фермент катализирует образование оксалоацетата из пирувата ( рис. 20 — 3) — анаплеротическую реакцию ( разд.
С-С, катализируют карбокси-лирующие ферменты, содержащие в качестве кофактора биотин, напр, пируваткарбоксилаза.
Сходным образом теряет организм и ту СО2, которая поглощается животными тканями при участии пируваткарбоксилазы в процессе глюконеогенеза ( разд.
Во всех случаях общее содержание связанного металла эквимолярно содержанию биотина в ферменте, за исключением пируваткарбоксилазы из печени крысы.
Первое указание на участие связанного с белком иона металла в био-тинзависимом транскарбоксилировании кетокислот было сделано на основании ЯМР-исследований пируваткарбоксилазы из печени цыпленка. Следовательно, ионы металлов, связанные с белком, могут играть существенную роль в биотинзави-симом транскарбоксилировании а-кетокислот.
В настоящее время информация, полученная при прямом ис-ледовании такого рода ферментов, главным образом вытекает из [ зучения ЯМР-спектров пируваткарбоксилазы из печени цыплен -: а. Эти ( сследования рассмотрены в работах , здесь же приведено только краткое их изложение. Изучение скоростей релакса-ции для взаимодействия Мп2 — протоны воды ( разд. Этот харак-ер участия марганца в реакции пируваткарбоксилазы подтвер-кдается изучением влияния связанного иона металла на скорости щерной магнитной релаксации протонов пирувата и оксалоацета — а.
В отличие от железа, меди и цинка для марганца существует лишь три фермента первого типа, а именно аргиназа, пируваткарбоксилаза и супероксиддисмута-за.
Следует упомянуть здесь также и о том, что глюконеогенез в печени подчиняется определенному гормональному контролю и что наиболее резко выраженное повышение содержания было отмечено для таких ферментов, как фруктозо-1 6-дифосфатаза, глюкозо-6 — фосфатаза и пируваткарбоксилаза.
В одной молекуле пируваткарбоксилазы, выделенной из ми-трхондрий печени птиц, содержится четыре атома марганца, а также четыре молекулы биотина. Пируваткарбоксилаза необходима для синтеза углеводов из пировиноградной кислоты, Было показано, что марганец находится на внешней поверхности фермента и, по-видимому, активирует метильную группу пи-рувата, оттягивая на себя электроны. В результате метиль-в я группа приобретает способность акцептировать двуокись укяерода с образованием оксалацетата
У цыплят при дефиците марганца вместо него в состав пируваткарбоксилазы включается Mg2, что не оказывает сущест-8 шого влияния на активность фермента [ Scrutton M. Пируваткарбоксилаза из печени млекопитающих содержит ионы обоих металлов. Ионы марганца участвуют не только в стадии транскарбоксилирования пирувата, но и в начальной стадии карбоксилирования биотина.
Может происходить и противоположное: присоединение какого-нибудь соединения может вызывать активацию фермента. Так, пируваткарбоксилаза активируется при добавлении ацетилкофермен-та А.
Превращение лактата в щавелевоуксусную кислоту осуществляется путем карбоксили-рования пировиноградной кислоты. Атера [ 311, является аллосте-рическим эффектором пируваткарбоксилазы. Добавление в систему ацетоуксуснои кислоты вызывает накопление ацетилкофермента А, который в свою очередь ускоряет карбоксилиро-вание пировиноградной кислоты и обеспечивает этим быстрое превращение лактата в глюкозу.
Специфической потребностью в Мп2 обладает поразительное число ферментов. К ним относятся галактозил — и N-ацетилгалактозаминил-трансферазыв, участвующие в синтезе мукополисахаридов ( гл. Пируваткарбоксилаза содержит четыре прочно связанных иона Мп2, по одному на каждую из молекул биотина. Ион марганца необходим для каталитического действия фермента на стадии транскарбоксилирования; помимо этого, Мп2 или Mg2 нужны на начальной стадии карбоксилирования биотина.
Механизм фосфорилитического отщепления остатка глюкозы от гликогена.
Гликогенфосфорилазаили простофосфорилазасуществует в двух
формах: А и В.
Форма А более активна, чем В.
Оличаются они друг от друга тем, что
фосфорилаза А это тетрамер, состоящий
из 4-х субъединиц с Мr=360000Да
фосфорилаза В – димер, содержащий две
субъединицы, его Мr=180000Да.
Превращение неактивной формы в активную
протекает по схеме:
2фосфорилазы В + 4 АТФакт.киназа
фосфорилазы Вфосфорилаза А + 4
АДФ
Под действием адреналина и глюкогона
запускается каскад реакций, который
заканчивается распадом гликогена.
Каскадный механизм
мобилизации и синтеза гликогена
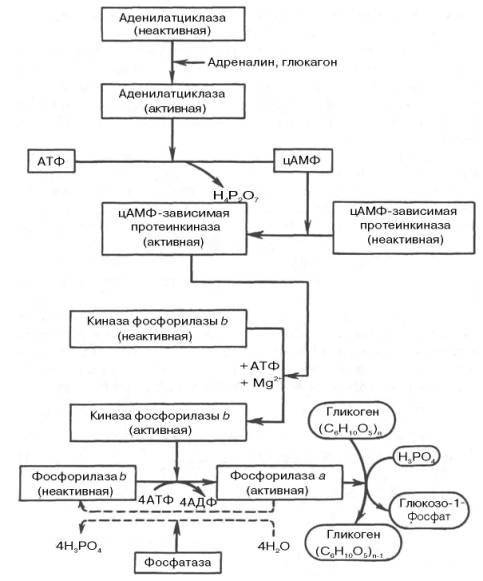 Неактивная
Неактивная
киназа фосфорилазы превращается в
активную под влияниемфермента
цАМФ-зависимой
протеинкиназы.
Активная форма последней
образуется при участиицАМФ,
которая в свою очередь образуется изАТФ
под действиемферментааденилатциклазы,
стимулируемой, в частности,адреналином
и глюкагоном.
Увеличение содержанияадреналина
в крови
приводит в этой сложной цепи реакций
к превращению фосфорилазы В в фосфорилазу
А и, следовательно, к освобождению глюкозы в
виде глюкозо-1-фосфата из запасного
полисахарида
гликогена.
Обратное превращение фосфорилазы А в
фосфорилазу В катализируется ферментом
фосфатазой
(эта реакция
практически необратима).
При отсутствии потребности организма
в дополнительной глюкозе распад гликогена
прекращается.
Под действием специфических
ферментов происходит инактивирование
фосфорилазы А
и активирование гликогенсинтазы
I,
начинается синтез гликогена.
Т.о. активирование 1-го
фермента каскада – аденилатциклазы
приводит к увеличению распада гликогена
и подавлению его синтеза.
Энергетические затраты глюконеогензу
Формирование глюкозы с пирувата является термодинамически невыгодным процессом, поэтому оно должно быть сопряжено с екзергоничнимы реакциями, а именно гидролиза нуклеотидтрифосфатив. Суммарное уравнение глюконеогенеза, в случае, когда исходным веществом выступает пируват, выглядит следующим образом:
- 2 Пируват + 4АТФ + 2ГТФ + 2НАДH (H +) + 4H 2 O → глюкоза + 4АДФ + 2ГТФ + 6Ф н + 2НАД +;
Так что для образования одной молекулы глюкозы необходима энергия шести високоенргетичних фосфатных групп (четырех от АТФ и двух от ГТФ). Также в этом процессе используются две молекулы НАДH для восстановления 1,3-бисфосфоглицерату.
Для сравнения суммарное уравнение гликолиза:
- Глюкоза + 2АДФ + 2Ф р +НАД + → 2 пируват + 2АТФ + 2H 2 O + НАДH (H +)
Очевидно, что глюконеогенез не является просто обратным к гликолиза, поскольку в таком случае для его прохождения хватало бы всего двух молекул АТФ. Глюконеогенез относительно энергетически «дорогой» метаболический путь, много с энергии требуется для обеспечения его необратимости. По клеточных условий суммарное изменение свободной энергии в процессе гликолиза составляет около -63 кДж / моль, а в глюконеогенезе — -16 кДж / моль.
Образование — гликоген
Образование гликогена из аминокислот, глицерина и других несахарных веществ называется гликонеогенезом.
Образование гликогена из глюкозы и обратное превращение гликогена в глюкозу происходит в результате ферментативных процессов фосфорилирования и дефосфорилирования. При синтезе гликогена глюкоза фосфорилируется в 6-фосфорный эфир глюкозы, последний затем изомеризуется в 1-фосфорный эфир глюкозы, который далее, в реакции обратной фосфоролизу, превращается в гликоген. Те же реакции, протекающие в обратном направлении, ведут к образованию глюкозы из гликогена.
Образование гликогена из глюкозо-1 — фосфата требует синтеза в качестве промежуточного продукта УДФ-глюкозы.
Механизм образования гликогена в печени из глюкозы в настоящее время выяснен.
|
Синтез гликогена. |
Реакция, приводящая к образованию гликогена, происходит при переносе глюкозного остатка, входящего в состав УДФ-глюкозы, на глико-зидную затравочную цепь гликогена.
Мощный глюкокортико-стероид; стимулирует глюконеогенез и образование гликогена, способствует расщеплению жиров и белков.
Для выяснения роли молочной кислоты в образовании гликогена в пищу крысам вводились лактаты, меченные радиоактивным углеродом в разных положениях.
Примером регуляции биосинтеза по принципу положительной обратной связи является образование гликогена в животных клетках.
Количество его может достигать у взрослого человека 150 — 200 г. Образование гликогена при относительно медленном поступлении сахара в кровь происходит достаточно быстро, поэтому после введения небольшого количества углеводов повышения содержания глюкозы в крови ( гипергликемия) не наблюдается. Если же в пищеварительный тракт поступает большое количество легкорасщепляющихся и быстровсасывающихся углеводов, содержание глюкозы в крови быстро увеличивается. Развивающуюся при этом гипергликемию называют алиментарной, иначе говоря — пищевой.
Кажется возможным существование пути полного синтеза молекулы гликогена de novo, помимо пути образования гликогена с использованием предобразованных затравок.
Ферментативные реакции, приводящие к утилизации глюкозы — фосфорилирование и окисление ее, а также образование гликогена протекают внутри клетки. Способствуя транспорту глюкозы внутрь клетки, инсулин тем самым обеспечивает ее утилизацию. Вместе с тем он не оказывает влияния на утилизацию углеводов бесклеточными гомоге-натами тканей ( гомогенаты получают путем растирания клеток, при котором разрушаются клеточные мембраны), так как механизм влияния инсулина на углеводный обмен связан именно с действием его на проницаемость клеточной мембраны.
Опыты с меченой уксусной кислотой указывают на возможность использования обоих атомов углерода молекулы уксусной кислоты для образования гликогена. Однако путь этих превращений еще недостаточно выяснен.
Следует заняться поисками мутантов, лишенных подобного рода альтернативных синтетических путей. Образование гликогена у прокариот отличается от других путей синтеза полисахаридов, и получение мутантов, дефектных по ключевым ферментам этого пути ( ADP-глюкозопирофосфо-рилазе и гликоген-синтетазе), является эффективным решением данной проблемы. Однако для реализации этого подхода необходимо иметь представление о регуляторных механизмах обоих путей. Некоторые виды продуцентов курдлана синтезируют также значительные количества сукциноглюкана. Были получены мутанты Alcaligenes spp.
Гистидин уменьшает кетонурию у взрослых крыс-самок, находящихся на диэте с высоким содержанием жиров. Образование гликогена печени начинается только через 8 часов после введения препарата, а максимальное отложение наблюдается через 16 часов.
Биологическая функция
ФЕП-карбоксилаза выполняет три главные функции:
- Первичная фиксация углекислоты в форме бикарбоната в клетках мезофилла листа при С4-фотосинтез,
- Первичная фиксация углекислоты при CAM-фотосинтезе
- И поддержание уровня интермедиатов в цикле трикарбоновых кислот.
Основной механизм ассимиляции углекислоты растениями происходит через фермент рибулозо-1,5-дифосфаткарбоксилазу-оксигеназу (Рубиско), которая присоединяет СО2 к рибулозо-1,5-дифосфату (пяти углеродный сахар) с образованием двух молекул 3-фосфоглицерата. Однако при высоких температурах и низкой концентрации СО2 Рубиско вместо углекислого газа присоединяет кислород, что приводит к образованию метаболически инертного продукта гликолата, который перерабатываться в процессе фотодыхания. Чтобы предотвратить это бесполезный процесс, растения могут увеличивать локальную концентрацию CО2 с помощью С4-фотосинтеза. ФЕП-карбоксилаза играет ключевую роль в фиксации СО2 в виде бикарбонат-аниона, соединяя его с ФЕП для создания оксалоацетата в ткани мезофилла. Затем оксалоацетат превращается обратно в пируват (через малат), чтобы высвободить СО2 в более глубоком слое обкладки проводящего пучка, где углекислый газ фиксируется Рубиско в цикле Калвина. Пируват преобразуется обратно в ФЕП в клетках мезофилла, и цикл начинается снова. Таким образом происходит активное концентрирование СО2.
Вторая важная и очень похожая функция ФЕП-карбоксилазы — участие в CAM-фотосинтезе. Этот метаболический путь распространен у растений, живущих в засушливых местообитаниях. Растения не могут позволить открытые устьица в течение дня, чтобы поглощать CО2, так как при этом теряется слишком много воды в процессе транспирации. Вместо этого устьица открываются ночью, когда испарение воды минимально, CО2 Связывается путём фиксации ФЕП-карбоксилазой в форме оксалоацетата. Оксалоацетат затем превращается в малат с помощью фермента малатдегидрогеназы и депонируется в вакуоли, а затем используется в течение дня, когда световые реакции генерируют достаточно энергии (главным образом в виде АТФ) и восстановительных эквивалентов (НАДФН) для работы цикла Кальвина.
Третья функция ФЕП-карбоксилазы не связана с фотосинтезом. Аналогично пируваткарбоксилазе, ФЕП-карбоксилаза пополняет пул оксалоацетата в цикле трикарбоновых кислот. Образовавшийся в ходе гликолиза ФЕП преобразуется в пируват, который превращается в ацетил-КоА и поступает в ЦТК, где взаимодействует с оксалоацетатом, образуя цитрат. Чтобы увеличить поток вещества через цикл часть ФЕП преобразуется в оксалоацетат с помощью ФЕП-карбоксилазы, восполняя оксалоацетат, который откачивается из цикла для синтеза биомолекул клетки
ЦТК представляет собой центральный путь обмена веществ, поэтому увеличение потока проходящего через него вещества важно для биосинтеза многих молекул, например аминокислот.
Образование — глюкоза
В организме пища перерабатывается с образованием глюкозы СбН Об, жира и других веществ, при окислении которых выделяется теплота.
В принципе реакцию можно довести до образования глюкозы, но обычно образуются промежуточные сахариды, построенные по типу целлюлозы, или более высокомолекулярные продукты. Процесс гидролиза в значительной степени зависит ог степени упорядоченности макромолекул целлюлозы. Чем меньше эта упорядоченность, тем более доступны участки макромолекул в неупорядоченных областях атаке гидролизующих агентов. По типу кислотного гидролиза целлюлозы протекает микробиологическая деструкция ее под действием природных ферментов.
Фермент сахараза катализирует гидролитическое расщепление сахарозы с образованием глюкозы и фруктозы.
Под действием ферментов гликованилин легко расщепляется с образованием глюкозы и ванилина. Ванилин является ценным душистым веществом, его применяют в пищевой и парфюмерной промышленности, а также для производства некоторых медицинских препаратов.
|
Пути превращения глюкозо-6 — фосфа-та в печени. Здесь, так же как и на 24 — 10 и 24 — 11, пути биосинтеза показаны стрелками, направленными вверх, пути распада-стрелками, направленными вниз, а распределение по другим органам-горизонтальными стрелками. |
Избыток глюкозо-6 — фосфата, не использованного для образования глюкозы крови или гликогена печени, распадается в ходе гликолиза и последующего действия ггаруватдегидрогеназы до аце-тил — СоА, который превращается в мало-нил — СоА и далее в жирные кислоты ( разд. Жирные кислоты идут на образование триацилглицеролов и фосфолипидов ( разд. Определенная доля ацетил — СоА в печени идет на синтез холестерола ( разд.
|
Энтальпии образования при 298 К и р — 1 атм, ккал / моль. |
Эта реакция прямым путем неосуществима, однако теплоту образования глюкозы можно найти путем расчета по закону Гес-са из других термохимических величин.
Эта реакция прямым путем неосуществима, однако теплоту образования глюкозы можно найти путем расчета по закону Гесса из других термохимических величин.
Так как таннин при действии кислот или щелочей гидролизуется с образованием глюкозы, дигалловой и галловой кислот, то он может быть определен по волне окисления галловой кислоты.
Для этого целлюлоза подвергается под действием сильных кислот гидролизу с образованием глюкозы. Источником глюкозы могут служить также сульфитные щелока — отход бумажно-целлюлозной промышленности.
Фото — и хемоавтотрофы способны также к восстановлению СОа с образованием глюкозы. В клетках гетеротрофных организмов источником глюкозы могут быть продукты превращения аминокислот, молочной к-ты и др. соединения.
Этот термин применяют иногда и для обозначения процесса расщепления гликогена с образованием глюкозы.
В результате такого возбуждения нервной системы часть гликогена печени распадается с образованием глюкозы, причем отложения гликогена в печени перестают быть видимыми под микроскопом. Концентрация глюкозы в крови при этом повышается. Этот процесс часто называют м о б и-л и з а ц и е и гликогена.
Этот термин применяют иногда и для обозначения процесса расщепления гликогена с образованием глюкозы.
Гликолиз
В клетках человека и других
высших организмов образование энергии
происходит не только в просе окислительного
фосфорилирования (аэробным
путем), но и в ходе
распада питательных веществ без участия
О2
(анаэробным путем).
Главным источником получения энергии
анаэробным путем служат гексозы,
прежде всего α-Д-глюкоза.
Гликолиз
– это анаэробный распад глк до 2-х молекул
молочной кислоты (лактата), протекающих
в гиалоплазме клетки.

Суммарное
уравнение анаэробного гликолиза

Это экзергонический процесс
(выделяется энергия). Освобождающаяся
в результате гликолиза энергия
аккомулируется вфосфатных связях
АТФ.
По имени авторов, изучавших этот процесс
более проблемно, гликолиз называют
путем Элебдена-Мейергофа-Парнаса.
Отдельные стадии гликолиза катализируются
11-ю ферментами.
Анаэробный гликолиз можно подразделить
на две стадии:
|
1 стадия — |
активирование |
|
2 стадия — |
Включает |
1 Стадия
1.↓
Р-ция фосфорилирования глк, т.е. перенос
остатка ортофосфата
на глюкозу за
счет АТФ.
Реакция
катализируется ферментом
гексокиназой:
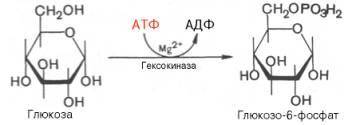
Образование глюкозо-6-фосфата в
гексокиназной реакциисопровождается освобождением
значительного количества свободной
энергии системы ипрактически
необратимым процессом.
Глк-6-ф в отличии от глк, не проходит
через мембрану и как бы «запирается в
клетке».
Гексокиназа существует в виде четырех
изомеров. Первые три преобразуют
различные виды гексоз, включая глк.
Гексокиназа IV(глюкокиназа)
фосфорилирует только глк, имеется в
печени, включается в работу при
значительных концентрациях глк в крови
воротной вены. Остальные изоформы
существуют во всех органах и тканях.
Гексокиназыа ингибируется
глюкозо-6-фосфатом, т.е. последний служит
одновременно и продуктом реакции,
и аллостерическим ингибитором.

Эта реакция протекает
легко в обоих направлениях,
и для нее не требуется каких-либо
кофакторов.
3.↓Образовавшийся фруктозо-6-фосфат
фосфорилируется за счет второймолекулы АТФ:
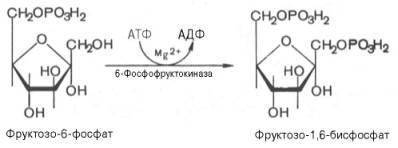
Данная реакция аналогично
гексокиназной практически
необратима и
является наиболее
медленно текущейреакциейгликолиза,
так как здесь происходит резкое падение
свободной энергии.
Фермент фосфофруктокиназапо своей
природе аллостерический фермент.
Она ингибируется АТФ и
стимулируется АМФ .
При значительных величинах отношения
АТФ/АМФ
активность
фосфофруктокиназы угнетается и
гликолиз
замедляется. Напротив, при снижении
этого коэффициента интенсивность
гликолиза повышается.
Во время работы мышцы происходит
интенсивное потребление АТФ и активность
фосфофруктокиназы повышается, что
приводит к усилению процесса гликолиза.
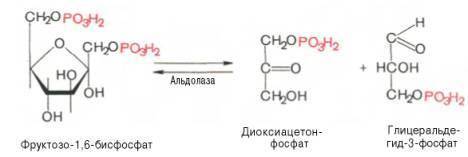 Эта реакция обратима.
Эта реакция обратима.
При повышениитемпературы реакциясдвигается
в сторону большего образования
триозофосфатов (дигидроксиацетонфосфата
и глицеральдегид -3-фосфата).

Равновесие
данной реакции сдвинуто
в сторону дигидроксиацетонфосфата.
Образуется 95% дигидроксиацетонфосфата
и 5% глицеральдегид-3-фосфата.В
последующие реакции
гликолиза
включается только глицеральдегид-3-фосфат.
По мере его потребления в ходе дальнейших
превращений дигидроксиацетонфосфат
превращается в глицеральдегид-3-фосфат.
Пируваткарбоксилаза
|
Пируваткарбоксилазная реакция и ее стимуляция положительным модулятором ацетил — СоА. Включившаяся СО2 показана на красном фоне. |
Пируваткарбоксилаза — очень сложный фермент. Молекула фермента содержит четыре простетические группы. Каждая из них состоит из одной молекулы витамина биотина ( разд.
|
Простатическая группа лируваткар-боксилазы. Карбоксильная группа биотина образует пептидную связь с е-аминогруппой остатка лизина, входящего в состав активного центра фермента. СО2 активируется, образуя N-карбоксипроизводное биотинилыюй просте-тической группы. Затем эта карбоксильная группа-непосредственный донор СО2 для пи-рувата-переносится на пируват. |
Пируваткарбоксилаза принадлежит к регуляторным ферментам. Избыток же ацетил — СоА, поставляющего топливо для цикла лимонной кислоты, стимулирует пируваткарбоксилазную реакцию; в результате этого образуется больше оксалоацетата и цикл использует больше ацетил — СоА в цитрат-синтазной реакции.
|
Противоположно направленные пути гликолиза и глюконеогенеза в печени крысы ( путь глюконеогенеза показан красным. У некоторых видов фосфоенолпируват образуется в цитозоле без участия митохондрий. На схеме показаны также два главных регулятор-ных пункта глюконеогенеза. Г6Ф — глюкозо-б-фосфат. ПФ-глюкозо-1 — фосфат. ФбФ — фрук-тозо-6 — фосфат. ФДФ — фруктозодифосфат. ГЗФ — глицеральдегид-3 — фосфат. Д ГАФ — дигид-роксиацетонфосфат. ФГФ — 3-фосфоглицероил-фосфат. ЗФГ-3-фосфоглицерат. 2ФГ — 2-фосфо-глицерат. |
Пируваткарбоксилаза — регуляторный фермент; в отсутствие ацетил — СоА, который служит для нее положительным регулятором, она почти полностью лишена активности.
|
Наличие связанных ионов металлов в различных биотинзависимых ферментах. |
Пируваткарбоксилаза, выделенная из печени цыплят, выращенных при очень низкой концентрации Мп, содержит Mn Mg в том же соотношении, что и их содержание в корме.
Пируваткарбоксилаза является высокоспецифичным ферментом, катализирующим уникальную реакцию усвоения СО2 в организме животных.
Пируваткарбоксилаза, которая катализирует эту реакцию, является аллостери-ческим митохондриальным ферментом. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата.
|
Последовательность реакций при ассимиляционной нитратредукции ( Е — ассимиляционная нитратредуктаза. Е2 — ассимиляционная нитритредуктаза. |
ФЕП с помощью пируваткарбоксилазы и ФЕП-карбоксикиназы, фруктозе-1 6-бисфосфат преобразуется во фруктозо-6 — фосфат с помощью фруктозобисфосфатазы, глюкозо-6 — фосфат превращается в глюкозу под действием глюкозо-6 — фосфатазы.
В одной молекуле пируваткарбоксилазы, выделенной из ми-трхондрий печени птиц, содержится четыре атома марганца, а также четыре молекулы биотина. Пируваткарбоксилаза необходима для синтеза углеводов из пировиноградной кислоты, Было показано, что марганец находится на внешней поверхности фермента и, по-видимому, активирует метильную группу пи-рувата, оттягивая на себя электроны. В результате метиль-в я группа приобретает способность акцептировать двуокись укяерода с образованием оксалацетата
Реакция (XI.36) катализируется А ТФ-зависимой пируваткарбоксилазой — ферментом, локализованным в митохондриях. Этот фермент проявляет большое сродство к НСО; карбоксилирование биотина, связанного с ферментом, аллостерически активируется под действием ацетил — КоА, вследствие чего равновесие реакции сдвинуто в сторону образования оксалоацетата. Фермент наиболее активен в условиях, когда организм нуждается в максимальной окислительной активности и в производстве энергии.
У цыплят при дефиците марганца вместо него в состав пируваткарбоксилазы включается Mg2, что не оказывает сущест-8 шого влияния на активность фермента
Предшественники в синтезе глюкозы
| Глюкогенных аминокислоты | |
|---|---|
| Аланин | Пируват |
| Цистеин | |
| Глицин | |
| Серин | |
| Треонин | |
| Триптофан | |
| Аргинин | α-кетоглутарат |
| Глутамат | |
| Глутамин | |
| Гистидин | |
| Пролин | |
| Изолейцин | Сукцинил-КоА |
| Метионин | |
| Треонин | |
| Валин | |
| Фенилаланин | Фумарат |
| Тирозин | |
| Аспарагин | Оксалоацетат |
| Аспартат |
Пируват и промежуточные продукты ЦТК
Опасный метаболический путь глюконеогенеза может использоваться для биосинтеза глюкозы не только с пирувата и лактата, а также и многих других веществ, в частности промежуточных продуктов цикла трикарбоновых кислот (ЦТК). Такие соединения как цитрат, изоцитрат, α-кетоглутарат, сукцинил-КоА, сукцинат, фумарат и малат превращаются в ходе ЦТК к оксалоацетата, а следовательно могут быть субстратами для глюконеогенеза.
Кабронови скелеты большинства аминокислот также могут быть преобразованы до пирувата или промежуточных продуктов ЦТК и выступать предшественниками глюкозы, они называются глюкогенных. Среди 20 стандартных аминокислот только две: лейцин и лизин не могут использоваться для синтеза глюкозы.
Среди глюкогенных аминокислот наибольшее значение для глюконеогенеза имеют аланин и глутамин, поскольку они выступают основными переносчиками аминогрупп от различных органов к печени. В митохондриях гепатоцитов от них отщепляются аминогруппы, а карбоновые скелеты используются на биосинтез глюкозы.
Глицерин
Предшественником в синтезе глюкозы также может выступать продукт гидролиза нейтральных жиров гилцерол. Для этого в клетках печени он фосфорилируется глицеролкиназою, после чего происходит окисление второго атома углерода и образуется глицеральдегид-3-фосфат, который может вступать в глюконеогенез. Хотя глицеролфосфат является важным предшественником в синтезе триглицеридов в адипоциты, эти клетки не имеют глицеролкиназы. Поэтому они используют для синтеза этого вещества сокращенный вариант глюконеогенеза: гилцеронеогенез, включающий преобразование пирувата в дигидроксиацетонфосфату с его последующим восстановлением до глицеролфосфату.
Жирные кислоты
Большинство жирных кислот (как и две неглюкогенни аминокислоты лейцин и лизин) расщепляются до ацетил-КоА, который в организме животных не может быть использован для глюконеогензу за отсутствия метаболического пути превращения ацетил-КоА в пируват или оксалоацетат. Однако у растений некоторых грибов (в том числе дрожжей), водорослей, простейших и бактерий имеется модифицированный вариант ЦТК глиоксилатный цикл, позволяет синтезировать оксалоацетат с ацетил-КоА. Таким образом эти организмы могут использовать жирные кислоты для синтеза глюкозы. У растений этот путь важен во время прорастания семян, к тому времени как у молодого растения появятся листья и начнется полноценный фотосинтез, она должна полагаться на запасные жиры в качестве источника энергии и строительных блоков, в частности для синтеза клеточных стенок.
Механизм катализа
Механизм катализа ФЕП-карбоксилазы довольно хорошо изучен. Реакция образования оксалоацетата является высокоэкзотермической и потому необратима; изменение энергии Гиббса для этого процесса (△G°’) составляет −30 кДж/моль. Субстрат и кофактор связываются в следующем порядке: ион металла (Cо2+, Mg2+ или Mn2+), ФЕП и гидрокарбонат (НСО3−). Реакция протекает в два основных этапа, как описано ниже и показано на схеме:
Схема каталитического механизма ФЕП-карбоксилазы
1. Гидрокарбонат выступает как нуклеофил и атакует фосфатную группу ФЕП. Это приводит к расщеплению ФЕП на карбоксифосфат (активированную форму CO2) и очень реакционноспособную енольную форму пирувата.
2. На карбоксифосфат переносится протон. В этом процессе участвует остаток гистидина (H138), который сначала отщепляет протон от карбоксильной группы, а затем, как кислота, переносит его на фосфат. После этого карбоксифосфат разлагается на углекислый газ и неорганический фосфат с выделением энергии, что делает реакцию необратимой. Наконец, углекислый газ подвергается атаке енолата в результате чего и образуется оксалоацетат.
Двухвалентный катион координирует енолат и углекислый газ в ходе реакции; молекула СО2 теряется только в 3 % случаев. Активный центр фермента является гидрофобным и не пропускает воду, поскольку карбоксифосфат довольно легко гидролизуется.
Список источников
- info-farm.ru
- www.ngpedia.ru
- wiki2.org
- StudFiles.net
