Распад — гликоген
Распад гликогена в печени происходит под влиянием фермента фосфорилазы, которую активирует адреналин. При этом образуется сложный эфир — глюкозофосфат; последний при участии фермента фосфатазы расщепляется на глюкозу и фосфорную кислоту. Освободившаяся кислота может быть использована на синтез глюкозофос-фата, а глюкоза поступает в кровь. Таким образом, убыль сахара в крови все время пополняется за счет гликогена печени.
Распад гликогена может протекать путем гидролиза, который приводит сначала к образованию мальтозы, а затем глюкозы, или посредством фосфоролитического расщепления. Гидролиз протекает под влиянием ферментов амилазы и мальтазы.
Распад гликогена может протекать путем гидролиза, который приводит сначала к образованию мальтозы, а затем глюкозы или посредством фосфоролитического расщепления. Гидролиз протекает под влиянием ферментов амилазы и мальтазы. Фосфоролитическое расщепление состоит в основном из следующих этапов.
Ферменты распада гликогена ( фосфорилаза) и его синтеза ( гликогенсинтаза) являются регуляторными. Регуляция осуществляется методом химической модификации: фосфорилированием-дефрсфо-рилированием; обычно оба фермента подвергаются ей синхронно.
При распаде гликогена в м скулах н других животных тканях, под влиянием фермента фосфорпдачы ( процесс фоефоро. При yro i фосфорпдаза мо ксг во хЧепствовать лишь па определенные части разветвленной молек лы гликогена, причем фоефороднз гликогена может идти до конца только при одновременном действии второго фермента — амндо-1 6-глюко.
|
Регуляция активности гликогенфосфорилазы путем ее ковалентной модификации. В активной форме фермента ( Фосфорилаза а специфические остатки серина ( по одному в каждой субъединице фосфорилированы. В результате ферментативного отщепления фосфатных групп, катализируемого фосфатазой фосфорилазы, Фосфорилаза а переходит в относительно неактивную фосфорилазу Ь. Фосфорилаза Ъ может реактивироваться и превратиться в фосфорилазу а под действием киназы фосфорилазы, катализирующей фосфорилирование гидроксильных групп серина за счет АТР. |
Итак, распад гликогена в скелетных мышцах и печени регулируется путем изменения количественных соотношений активной и неактивной форм фермента. Переход из одной формы в другую сопровождается изменениями четвертичной структуры фермента, затрагивающими и его каталитический центр. Естественно, что при этом каталитическая активность фермента изменяется.
В результате распада гликогена происходит накопление молочной кислоты и неорганических соединений ( например, фосфорной кислоты) за счет разложения сложных белковых веществ. Усиление кислой реакции среды способствует набуханию мышечных волокон ткани, их сокращению и повышению упругости.
Фосфоролитичеокий путь распада гликогена и крахмала характерен для внутриклеточного распада этих полисахаридов.
Наряду с фосфорилитическим распадом гликогена в мышцах имеет место ( правда, в значительно меньшей степени) и гидролитическое расщепление его под влиянием амилазы и мальтазы.
У крыс усиливается распад гликогена в печени и накапливаются некоторые промежуточные продукты гликолиза. У мышей ряд изменений ферментов: активация глюкозо-6 — фосфатазы, уменьшение содержания аденозинтрифосфатазы в.
Рассмотренный фосфоролитический путь распада гликогена и крах — мала, при котором образуется значительное количество глюкозо-1 — фосфата и тем самым экономится аденозинтрифосфат — основной энергетический, резерв клетки ( см. гл. При распаде полисахаридов под действием внеклеточных ферментов конечными продуктами расщепления являются моносахариды, что связано с невозможностью использования фосфатов Сахаров из-за их неспособности проникать через клеточные мембраны.
Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1 — фосфат превращается под действием фосфоглюкомутазы в глюкозо-6 — фосфат.
В первые часы хранения распад гликогена происходит преимущественно путем фосфоролиза, который прекращается после распада АТФ. Таким образом распадается до 90 % гликогена. Затем при более длительном хранении идет амилолитический распад оставшегося гликогена. При длительном хранении рыбы гликоген практически весь распадается.
|
Адреналин включает каскад усиления в клетках печени. Связывание нескольких молекул адреналина со специфическими рецепторами на поверхности клетки инициирует последовательность ферментативных реакций, в результате которых в кровь выбрасывается очень большое количество глюкозы. |
Гексокиназная реакция. Синтез и распад гликогена
Биологический смысл гексокиназной реакции:
— сделать молекулу глюкозы более способной к химическим реакциям, ослабить в ней химические связи;
— препятствовать выходу глюкозы обратно в кровь (глюкозо-6-фосфат не способен проходить через клеточную мембрану).
Для выхода молекулы из клетки глюкозо-6-фосфат должен превратиться обратно в глюкозу при участии глюкозо-6-фосфатазы. Она гидролизует глюкозо-6-фосфат до глюкозы и Н3РО4 (Фн), т.е. катализирует обходной обратный путь гексокиназной реакции. Глюкозо-6-фосфатаза есть в печени, почках и слизистой оболочке кишечника.
После образования глюкозо-6-фосфата существуют три главных пути:
— синтез гликогена;
— гексозомонофосфатный путь распада углеводов (ГМФ-путь);
— гексозобифосфатный путь распада углеводов (ГБФ-путь).
Синтез гликогена протекает в печени, мышцах и лейкоцитах. После образования глюкозо-6-фосфата (гексокиназная реакция) происходит внутримолекулярный перенос остатка фосфорной кислоты из 6-го положения в 1-е. При этом образуется глюкозо-1-фосфат. Затем протекает дополнительная активация глюкозного фрагмента. При этом расходуется одна молекула УТФ, что эквивалентно расходованию 1-й молекулы АТФ. В результате образуется активированная форма — УД Ф-глюкоза.
УДФ-глюкозный остаток переносится на молекулу гликогена. Удлинение цепи гликогена катализирует гликогенсинтетаза. Таким образом, цепь гликогена становится на 1 глюкозный фрагмент длиннее. Молекула гликогена сильно разветвлена. Формирование ответвлений обеспечивает специальный гликогенветвящий фермент.
Синтез молекулы гликогена — постепенное удлинение уже имеющегося кусочка цепи — затравки. Распад молекул также никогда не происходит полностью. Для включения одного остатка глюкозы в молекулу гликогена клетка расходует две молекулы АТФ. При распаде гликогена эта АТФ не регенерирует, освобождается только Фн (неорганический фосфат).
Ключевой фермент синтеза гликогена — гликоген-синтетаза, активируемая избытком глюкозо-6-фосфата. Катализируемая реакция необратима.
Для распада гликогена существует обходной обратный путь, ключевой фермент которого — гликоген-фосфорилаза (фосфорилаза). Фермент расщепляет молекулу гликогена с участием Фн (неорганического фосфата) до глюкозо-1-фосфата и гликогена, укороченного на один глюкозный фрагмент: (С6Н10О5)n + H3PO4 ——> (C6H10O5)n–1 + глюкозо-1-фосфат.
Гликогенфосфорилаза угнетается избытком АТФ, активируется избытком АДФ.
Обмен фруктозы и галактозы
Все реакции метаболизма этих соединений сводятся главным образом к образованию глюкозы. Также галактоза после взаимодействия с УТФ образует активированную УДФ – галактозу, которая при взаимодействии с глюкозой образует дисахарид лактозу и УДФ
Некоторые моносахариды служат предшественниками образования аминосахаров, которые являются важными компонентами гликопротеинов, некоторых гликосфинголипидов, например, ганглиозиды, и глюкозаминогликанаты, наиболее важное значение имеет глюкоза, галактоза, маннозамин, а также углерод9-соединения-сиаловая кислота
Некоторые другие клинические аспекты нарушения углеводного обмена: Лактоацидоз может быть вызван комплексованием сульфигдрильных групп липоевой кислоты, тяжелыми металлами и арсенатами
Также он вызывается недостатком В1 , мутацией перуватдегидрогеназы.
Существует также гипо- и гиперсостояния, связанные с глюкозой, фруктозой,
галактозой.
Болезни, связанные с накаплением гликогена (гликогенозы).
Обмен липидов.
Липиды – это гетерогенная группа соединений, общим свойством которых является нерастворимость в воде, а растворимость в полярных растворителях: эфир, хлороформ, бензол.
Все они непосредственно или апосредовано связаны с жирными кислотами. Вопросы:
- структура и функция липидов в организме человека,
- переваривание и всасывание жиров. Синтез желчных кислот
- образование транспортных форм липидов (жиров)
- обмен жирных кислот: |3-окисление, синтез жирных кислот; строение
пальмитатсинтазного комплекса. Регуляция. - метаболизм кетоновых тел
- обмен жиров: депонирование и мобилизация.
- обмен холестерина. Синтез, образования транспортных форм. Атеросклероз
Функции липидов в организме.
Они служат депонированным источником энергии, обеспечивают теплоизоляцию, являются структурными компонентами биологических мембран, выполняют регуляторную функцию (гормоны). Липиды классифицируются на:
- простые – это сложные эфиры жирных кислот с различными спиртами: жиры – это
эфиры жирных кислот и глицерина; воска – сложные эфиры жирных кислот с
многоатомными спиртами - сложные – это сложные эфиры жирных кислот со спиртами, дополнительно
содержащие другие группы.
– фосфолипиды (глицерофосфолипиды, сфинголипиды)
– гликолипиды
– другие сложные липиды: аминолипиды, липопротеины.
3. производные и предшественники липидов: глицерол, жирные кислоты, стероиды
(желчные кислоты, стероидные гормоны), кетоновые тела, жирорастворимые витамины
А, Д, Е, К и витамин или фактор F (включает в себя полиненасыщенные незаменимые
или эссенциальные жирные кислоты – линолевая, линоленовая и арахидоновая кислота).
Подробнее на стр. 188-203
Жиры или триацилглицериды (нейтральные жиры, триглицериды) – это сложные эфиры
глицерина и жирных кислот, являются главным компонентом жиров, запасаемых в
клетке.
Жиры могут находится в организме в двух видах:
- в виде капелек жиры в цитоплазме – цитоплазматический жир. Его количество и
состав не меняется с возрастом и состоянием организма, - запасный жир в жировых депо. Его количество меняется в зависимости от пола,
возраста и состояния организма.
Механизм
| Внешние изображения |
|---|
«Стартовой точкой» гликогеногенеза служит . Глюкозо-6-фосфат может быть получен из глюкозы в ходе реакции, I и гексокиназой II в мышцах и гексокиназой IV () в печени:
- D-глюкоза + ATP → D-глюкозо-6-фосфат + .

Однако поглощённая с пищей глюкоза может проделывать более сложный путь до глюкозо-6-фосфата. Сначала она попадает в , где гликолитически превращается в . Затем лактат поступает в печень, где в ходе глюконеогенеза превращается в глюкозу, а потом и глюкозо-6-фосфат.
Для инициации синтеза гликогена глюкозо-6-фосфат должен быть переведён в ферментом :
- Глюкозо-6-фосфат ⇌ глюкозо-1-фосфат.

Глюкозо-1-фосфат далее превращается в под действием , это является ключевым этапом в синтезе гликогена.
- Глюкозо-1-фосфат + UTP → UDP-глюкоза + PPi

Эта реакция образования нуклеотид-сахара в условиях , поэтому необратим и гликогеногенез. Конденсация уридинтрифосфата с глюкозо-1-фосфатом имеет небольшое положительное изменение , однако в ходе этой реакции выделяется (PPi), который быстро , а эта реакция сильно (ΔG’o = −19,2 кДж/моль). Таким образом концентрация пирофосфата в клетке поддерживается низкой, и образование нуклеотид-сахара оказывается выгодным для клетки энергетически. В действительности быстрое вовлечение продукта реакции в другие реакции, чему способствует большое отрицательное значение изменения энергии Гиббса при гидролизе пирофосфата, стимулирует дальнейшие реакции .
UDP-глюкоза является непосредственным донором глюкозных остатков в реакции, катализируемой , которая катализирует перенос глюкозного остатка с UDP-глюкозы на нередуцирующий конец разветвлённой молекулы гликогена.

Гликогенсинтаза создаёт (α1→4)-гликозидные связи, однако она неспособна создавать (α1→6)-, которые располагаются в точках ветвления гликогена. Эти связи образует , или амило-(1→4)-(1→6)-трансгликозилаза, или гликозил-(4→6)-трансфераза. Гликогеноразветвляющий фермент катализирует перенос терминального фрагмента длиной 6 или 7 глюкозных остатков с нередуцирующего конца ветви гликогена длиной не менее 11 остатков на гидроксильную группу при шестом атоме остатка глюкозы, располагающегося ниже, причём он может принадлежать как той же самой, так и другой цепи. Таким образом создаётся новая ветвь гликогена.

Дополнительные остатки глюкозы могут добавляться на новую ветвь гликогена под действием гликогенсинтазы. Биологический момент разветвления молекулы гликогена состоит в том, что это повышает растворимость гликогена и увеличивает число его нередуцирующих концов, которые являются сайтами активности (главный фермент ) и гликогенсинтазы.

Гликогениновый , окружённый двумя молекулами гликогена
Гликогенсинтаза не может начать синтез новой цепи гликогена с нуля. Для этого ей нужна затравка, которой может быть (α1→4)-полиглюкозная цепь или ветвь, содержащая не менее 8 глюкозных остатков. Образование затравки обеспечивает , который является и местом синтеза затравки, и этого процесса. Первым этапом синтеза новой молекулы гликогена является перенос остатка глюкозы с UDP-глюкозы на остатка Tyr194 гликогенина, обусловленный глюкозилтрансферазной активностью белка. Растущая цепь удлиняется за счёт последовательного добавления 7 или более глюкозных остатков, каждый из которых берётся от UDP-глюкозы, эта реакция также катализируется гликогенином. На этом этапе в синтез гликогена включается гликогенсинтаза, обеспечивающая дельнейшее удлинение гликогеновой цепи. После этого гликогенин в составе β-частицы, ковалентно присоединённой к единственному нередуцирующему концу молекулы гликогена.
Функции
Печень
Поскольку еда, содержащая углеводы или белок, съедается и переваривается, уровень глюкозы в крови повышается, а поджелудочная железа выделяет инсулин. Кровь глюкозы из воротной вены поступает в клетки печени (гепатоциты). Инсулин воздействует на гепатоциты, чтобы стимулировать действие нескольких ферментов, включая гликогенсинтазу. Молекулы глюкозы добавляются к цепям гликогена до тех пор, пока как инсулин, так и глюкоза остаются обильными. В этом постпрандиальном или «сытом» состоянии печень берет больше глюкозы из крови, чем высвобождает.
После того, как еда была переварена и уровень глюкозы начинает падать, секреция инсулина снижается, и синтез гликогена прекращается. Когда это необходимо для энергии, гликоген разрушается и снова превращается в глюкозу. Гликогенфосфорилаза является основным ферментом распада гликогена. В течение следующих 8-12 часов, глюкоза, полученная из гликогена печени, является основным источником глюкозы в крови, используемой остальной частью организма для получения топлива.
Глюкагон, еще один гормон, вырабатываемый поджелудочной железой, во многом служит противодействующим сигналом к инсулину. В ответ на уровень инсулина ниже нормы (когда уровень глюкозы в крови начинает падать ниже нормального диапазона), глюкагон секретируется в возрастающих количествах и стимулирует как гликогенолиз (распад гликогена), так и глюконеогенез (производство глюкозы из других источников).
Мышцы
Гликоген мышечной клетки, по-видимому, функционирует как непосредственный резервный источник доступной глюкозы для мышечных клеток. Другие ячейки, которые содержат небольшие количества, также используют его локально. Поскольку мышечным клеткам не хватает глюкозо-6-фосфатазы, которая требуется для приема глюкозы в кровь, гликоген, который они хранят, доступен исключительно для внутреннего использования и не распространяется на другие клетки. Это контрастирует с клетками печени, которые по требованию легко разрушают свой сохраненный гликоген в глюкозу и отправляют его через кровоток в качестве топлива для других органов.
Регуляция метаболизма гликогена
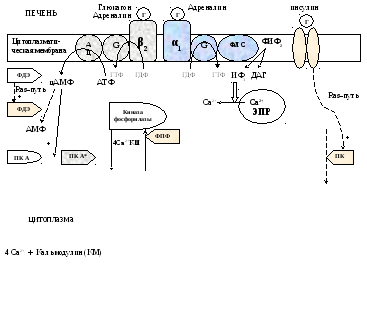
АТФ
АДФ
Глюкоза-1-ф
Гликоген
АТФ
АДФ
АТФ
АДФ
4Са2+
КМ
Са2+,
ДАГ
Н2О
Фн
Н2О
Фн
АТФ
АДФ
Метаболизм
гликогена контролируется гормонами (в
печени — инсулином, глюкагоном, адреналином;
в мышцах — инсулином и адреналином),
которые регулируют фосфорилирование
/дефосфорилирование 2 ключевых ферментов
гликогенсинтазы и гликогенфосфорилазы.
При
недостаточном уровне глюкозы в крови
выделяется гормон глюкагон, в крайних
случаях – адреналин. Они стимулируют
фосфорилирование гликогенсинтазы (она
инактивируется) и гликогенфосфорилазы
(она активируется). При повышении уровня
глюкозы в крови выделяется инсулин, он
стимулирует дефосфорилирование
гликогенсинтазы (она активируется) и
гликогенфосфорилазы (она инактивируется).
Кроме того, инсулин индуцирует синтез
глюкокиназы, тем самым, ускоряя
фосфорилирование глюкозы в клетке. Всё
это приводит к тому, что инсулин
стимулирует синтез гликогена, а адреналин
и глюкагон – его распад.
В
печени существует и аллостерическая
регуляция гликогенфосфорилазы: ее
ингибирует АТФ и глюкозо-6ф, а активирует
АМФ.
Нарушения
обмена гликогена
Гликогеновые
болезни— группа наследственных
нарушений, в основе которых лежит
снижение или отсутствие активности
ферментов, катализирующих реакции
синтеза или распада гликогена, либо
нарушение регуляции этих ферментов.
Гликогенозы— заболевания, обусловленные дефектом
ферментов, участвующих в распаде
гликогена. Они проявляются или необычной
структурой гликогена, или его избыточным
накоплением в печени, сердечной или
скелетных мышцах, почках, лёгких и других
органах.
В
настоящее время гликогенозы делят на
2 группы: печёночные и мышечные.
Печёночные формы гликогенозовведут
к нарушению использования гликогена
для поддержания уровня глюкозы в крови.
Поэтому общий симптом для этих форм —
гипогликемии в постабсорбтивный период.
Болезнь
Гирке(тип I) отмечают наиболее
часто. Причина — наследственный дефект
глюкозо-6-фосфатазы — фермента,
обеспечивающего выход глюкозы в кровоток
после её высвобождения из гликогена
клеток печени и почек. Клетки печени и
извитых канальцев почек заполнены
гликогеном, печень и селезенка увеличены,
у больных опухлое лицо — «лицо китайской
куклы». Болезнь проявляется гипогликемией,
гипертриацилглицеролемией, гиперурикемией,
ацидоз.
Лечение
— диета по глюкозе, частое кормление.
Болезнь
Кори(тип III) распространена, 1/4 всех
печёночных гликогенозов. Накапливается
разветвленный гликоген, так как дефектен
деветвящий фермент. Гликогенолиз
возможен, но в незначительном объёме.
Лактоацидоз и гиперурикемия не отмечаются.
Болезнь отличается более лёгким течением
чем болезнь Гирке.
Мышечные
формы гликогенозовхарактеризуются
нарушением в энергоснабжении скелетных
мышц. Эти болезни проявляются при
физических нагрузках и сопровождаются
болями и судорогами в мышцах, слабостью
и быстрой утомляемостью.
Болезнь
МакАрдла(тип V) — аутосомно-рецессивная
патология, отсутствует в скелетных
мышцах активность гликогенфосфорилазы.
Накопление в мышцах гликогена аномальной
структуры.
Агликогенозы
Агликогеноз(гликогеноз 0 по классификации) —
заболевание, возникающее в результате
дефекта гликогенсинтазы. В печени и
других тканях больных наблюдают очень
низкое содержание гликогена. Это
проявляется резко выраженной гипогликемией
в постабсорбтивном периоде. Характерный
симптом — судороги, проявляющиеся
особенно по утрам. Болезнь совместима
с жизнью, но больные дети нуждаются в
частом кормлении.
5.1.1. Анаэробное окисление глюкозы
Анаэробный гликолиз
включает 2 этапа:
-
Активация глюкозы
с затратой АТФ -
Окислительный
этап, идущий с образованием АТФ
На первом этапе
глюкоза расщепляется на 2 триозы:
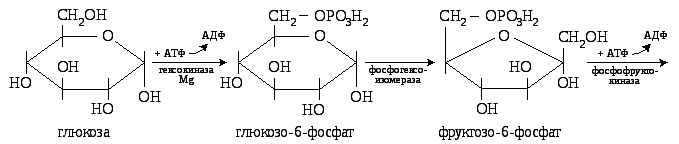
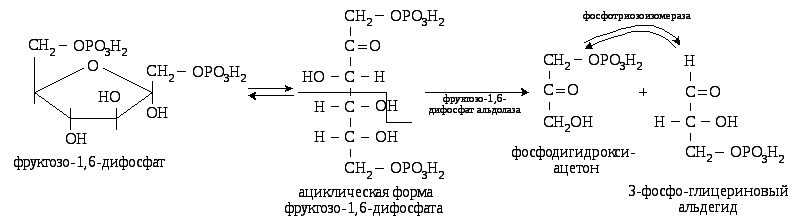
Таким образом, на
первом этапе гликолиза на активирование
глюкозы затрачивается 2 молекулы АТФ и
образуется 2 молекулы 3-фософоглицеринового
альдегида.
На второй стадии
окисляются 2 молекулы 3-фосфоглицеринового
альдегида до двух молекул молочной
кислоты.

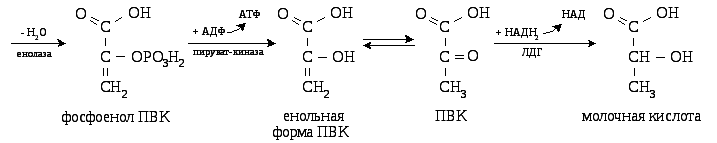
Значение
лактатдегидрогеназной реакции (ЛДГ)
заключается в том, чтобы в безкислородных
условиях окислить НАДН2в НАД и
сделать возможным протекание
глицеро-фосфатдегидрогеназной реакции.
Суммарное уравнение
гликолиза:
глюкоза + 2АДФ +
2Н3РО4→ 2лактат + 2АТФ + 2Н2О
Гликолиз протекает
в цитозоле. Его регуляцию осуществляют
ключевые ферменты –фософофруктокиназа,пируваткиназа. Эти ферменты
активируются АДФ и НАД, угнетаются АТФ
и НАДН2.
Энергетическая
эффективность анаэробного гликолиза
сводится к разнице между числом
израсходованных и образовавшихся
молекул АТФ. Расходуется 2 молекулы АТФ
на молекулу глюкозы в гексокиназной
реакции и фосфофруктокиназной реакции.
Образуется 2 молекулы АТФ на одну молекулу
триозы (1/2 глюкозы) в глицерокиназной
реакции и пируваткиназной реакции. На
молекулу глюкозы (2 триозы) образуется
соответственно 4 молекулы АТФ. Общий
баланс: 4 АТФ – 2 АТФ = 2 АТФ. 2 молекулы
АТФ аккумулируют в себе ≈ 20 ккал, что
составляет около 3% от энергии полного
окисления глюкозы (686 ккал).
Несмотря на
сравнительно невысокую энергетическую
эффективность анаэробного гликолиза,
он имеет важное биологическое значение,
состоящее в том, что это единственныйспособ образования энергии в безкислородных
условиях. В условиях дефицита кислорода
он обеспечивает выполнение интенсивной
мышечной работы в начальный период
физической нагрузки
В тканях плодаанаэробный гликолиз очень активен в
условиях дефицита кислорода. Он остаётся
активным в периодноворожденности,
постепенно сменяясь на аэробное
окисление.
Дальнейшее
превращение молочной кислоты
-
При интенсивном
поступлении кислорода в аэробных
условиях молочная кислота превращается
в ПВК и через ацетил КоА включается в
цикл Кребса, давая энергию. -
Молочная кислота
транспортируется из мышц в печень, где
используется на синтез глюкозы – цикл
Р. Кори.
Цикл Кори
При больших
концентрациях молочной кислоты в тканях
для предотвращения закисления (ацидоза)
она может выделяться через почки и
потовые железы.
Глюконеогенез
Глюконеогенез – это трансформация дезаминированных остатков аминокислот, глицерола и лактата в глюкозу. Как правило, глюконеогенез сопровождается быстрым поступлением новообразованной глюкозы в кровь, поскольку те физиологические условия, которые характеризуются высокой скоростью глюконеогенеза, обусловливают и «гипертрофию» фермента глюкозо-б-фосфатазы в печени, как бы ставящей штамп «только на экспорт» на большем, чем в норме, количестве молекул глюкозо-б-фосфата. Печень обладает уникальной способностью извлекать из притекающей крови определенные аминокислоты. Источником аминокислот, используемых для длительного подержания постоянной концентрации глюкозы в крови при голодании и других состояниях, служат белки других тканей организма, особенно мышц, на долю которых приходится около 50% общей массы тела. Важную роль в мобилизации белка периферических тканей с поступлением в печень аминокислот, большинство которых используется для глюконеогенеза, играют глюкокортикоиды. Часть аминокислот, несомненно, используется и для синтеза определенных белков в печени и других тканях.
Природа гормональных эффектов, определяющих блокаду периферического окисления глюкозы при голодании, точно не известна
В «торможении» утилизации глюкозы мышцами важное значение придается глюкокортикоидам и гипофизарному гормону роста.. Если бы в условиях углеводного голодания или хронической потери сахара через почечные канальцы скорость утилизации глюкозы тканями (кроме ЦНС) оставалась столь же высокой, как и в состоянии сытости, то проблема постоянного снабжения глюкозой мозга приобретала бы большую остроту, чем это есть на самом деле
Поэтому при голодании периферические ткани адаптивно снижают потребление глюкозы. Отчасти это происходит за счет общего снижения интенсивности обмена
Если бы в условиях углеводного голодания или хронической потери сахара через почечные канальцы скорость утилизации глюкозы тканями (кроме ЦНС) оставалась столь же высокой, как и в состоянии сытости, то проблема постоянного снабжения глюкозой мозга приобретала бы большую остроту, чем это есть на самом деле. Поэтому при голодании периферические ткани адаптивно снижают потребление глюкозы. Отчасти это происходит за счет общего снижения интенсивности обмена.
На примере мышц голодающих или получающих жировой рацион крыс можно наблюдать и истинную адаптацию тканей. Такие мышцы, инкубируемые in vitro с глюкозой и радиоактивно меченными жирными кислотами, окисляют меньше глюкозы и больше жирных кислот, чем мышцы контрольных сытых животных. Окисление углеводов в периферических тканях блокируется, и они начинают в большей степени использовать жирные кислоты. Это конечно, существенно облегчает задачу печени по поддержанию постоянной концентрации глюкозы в крови путем глюконеогенеза, поскольку большая доля новообразуемой глюкозы может поступать в жизненно важные ткани, особенно нуждающиеся в ней.
Список источников
- lifebio.wiki
- medimet.info
- www.ngpedia.ru
- howlingpixel.com
- cribs.me
- StudFiles.net
- kursak.net
