Введение.
Для
рациональной и безопасной фармакотерапии врачу и провизору необходимо знать
фармакокинетику и фармакодинамику.
Знание
механизма действия позволяет осмысленно выбрать необходимый препарат для
лечения конкретного заболевания. Кроме того, знание механизма действия
необходимо также для правильного комбинирования лекарств и предвидения
возможного возникновения нежелательных эффектов.
Знание
фармакокинетики лекарственного средства дает врачу возможность осуществить
индивидуальный подбор лекарственной терапии данному больному, исходя из
особенностей функционирования его организма. Кроме того, знание фармакокинетики
препарата позволяет предвидеть появление нежелательных эффектов, а также
помогает выбрать оптимальный режим дозирования при данном пути введения для
того, чтобы обеспечить терапевтическую концентрацию лекарственного вещества в
области рецептора.
Активным
средством в руках врача, с помощью которого он может влиять на течение того или
иного заболевания, является лекарственный препарат.
Лекарственное
средство в руках знающего врача приносит огромную пользу людям. Незнание
лекарственных средств, неумение пользоваться ими, низкие морально-этические требования
к себе могут привести к непоправимым последствиям для больного человека.
Нередко перед
врачом стоит сложная задача – выбрать из большого арсенала лекарственных
средств не только самое эффективное, но и наименее токсичное, а также уменьшить
риск появления побочного действия. Это в значительной мере обусловлено тем, что
при различных условиях одно и то же вещество может оказаться лекарством или
ядом. Так, стрихнин, морфин, фосфакол и другие ядовитые и сильнодействующие
лекарственные вещества в сравнительно небольших, так называемых терапевтических
дозах оказывают лечебный эффект. С увеличением доз этих ЛС выше допустимых они
могут проявлять токсическое действие, нередко приводящее к тяжелым
последствиям. Иногда обычные дозы ЛС вместо желаемого действия могут оказать
отрицательное влияние на организм, что связывают с индивидуальной
чувствительностью больных к этому ЛС. Отсюда вытекает необходимость знания
особенностей фармакодинамики и фармакокинетики лекарственных средств в
повседневной деятельности провизора.
Фармакодинамика-
раздел фармакологии, изучающий совокупность эффектов лекарственных средств и
механизмы их действия.
Содержание фармакологии.
Фармакология– это наука о взаимодействии биологических
объектов с химическими веществами.
Взаимодействие
лекарств и организма имеет две стороны:
действие лекарств на организм изучаетфармакодинамика, а действие организма
на лекарства –фармакокинетика.
Фармакодинамика– часть фармакологии, изучающая эффекты
лекарств и механизм их формирования.
Эффектылекарств– это те изменения в функционировании
различных органов и систем организма,
которые развиваются под действием
лекарственных препаратов. Их называют
такжевидами действиялекарств,
а механизмы формирования этих эффектов
–механизмами действия лекарств.
Механизмы действия лекарств можно
рассматривать как их эффекты на различных
уровнях организации живой материи: от
молекулярного до организменного.
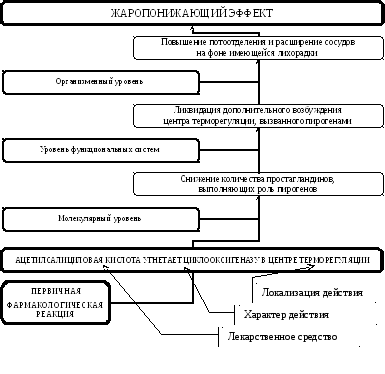
Поясним
данное положение на примере из частной
фармакологии (см. Рис. 1). Ацетилсалициловая
кислота
обладает жаропонижающим эффектом
(организменный уровень). Этот эффект
объясняется повышением потоотделения
и расширением сосудов на фоне имеющейся
лихорадки (это тоже эффекты ацетилсалициловой
кислоты, но их можно рассматривать и
как компонент механизма ее жаропонижающего
действия). Данные эффекты в свою очередь
можно объяснить снятием дополнительного
возбуждения центра терморегуляции,
вызванного пирогенами (мы спускаемся
на уровень функциональных систем). При
желании можно еще более глубоко
погрузиться в тонкости механизма
действия, рассмотрев физиологические
механизмы связи центра терморегуляции
и сосудодвигательного центра,
непосредственно регулирующего тонус
сосудов. Это как взгляд на одну и ту же
структуру через микроскоп с применением
все большего увеличения. Далее (при
переходе на молекулярный уровень) в
данном примере мы увидим снижение
количества простагландинов, выполняющих
в центре терморегуляции роль пирогенов.
Снижение количества простагландинов
в свою очередь объясняется ингибированием
синтезирующего их в условиях воспаления
фермента циклооксигеназы II типа. А
циклооксигеназа – это та молекула, с
которой ацетилсалициловая кислота
непосредственно взаимодействует в
организме (мишень). Обычно с подобной
первичной фармакологической реакции
и начинают изложение любого механизма
любого эффекта любого лекарственного
препарата. Мы сейчас произвели такое
рассмотрение в обратном порядке. Довольно
часто такое подробное объяснение
произвести не удается и отдельные
звенья, а то и целые блоки в механизме
действия лекарств приходится пропускать.
Часто это делается в связи с недостаточной
изученностью, впрочем, в значительном
ряде случаев авторы учебников
подразумевают, что имеют дело с
подготовленными читателями, которые
изучили физиологию, биохимию, общую
фармакологию и смогут самостоятельно
объяснить недостающие звенья механизма
действия.
Рис.
1.
Механизм
действия (схема) на примере жаропонижающего
эффекта ацетилсалициловой кислоты
Таким образом,
фармакодинамика изучает эффекты лекарств
и механизмы их формирования в одном
комплексе. Знание механизмов действия
лекарств позволяет врачу наиболее
рационально использовать фармакотерапию
с учетом индивидуальных особенностей
каждого больного. Именно изучение
механизмов действия является основной
задачей теоретической или экспериментальной
фармакологии.
Фармакокинетика– часть фармакологии, изучающая
всасывание лекарств при различных путях
введения, распределение в организме,
элиминацию (биотрансформацию и выведение),
т.е. их судьбу в организме.
Рис.
2.
Структура
фармакологии (схема)
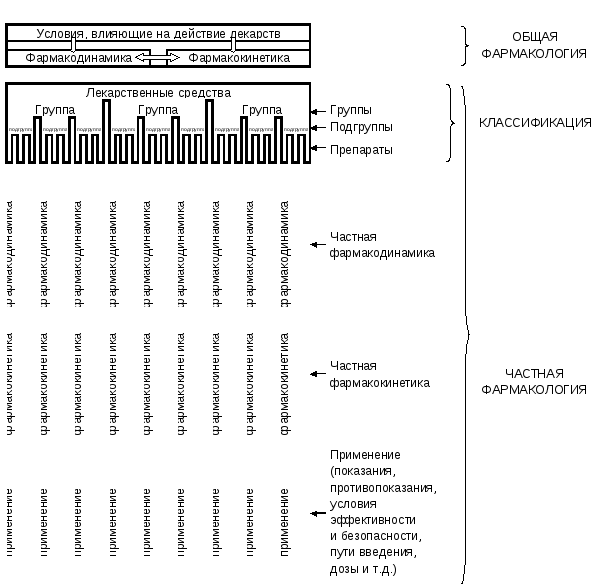 При
При
изучении фармакологии удобно также
выделять такие ее части, как общая и
частная фармакология. Общая фармакология
изучает закономерности взаимодействия
биологических объектов с химическими
веществами, характерные для всех или
многих лекарственных веществ,частная
– фармакодинамику и фармакокинетику
отдельных препаратов. Изучение
фармакологии рационально начинать с
общих вопросов, т.к. фармакология
отдельных препаратов подчиняется общим
закономерностям. Следовательно, понимание
общей фармакологии во многом облегчает
изучение частных тем, избавляя от
необходимости заучивания большого
объема материала для каждого препарата.
Прикладная фармакокинетика
Введение в фармакокинетику
- Основные фармакокинетические показатели
- Различные способы введения препарата
- Биодоступность
- Абсорбция препарата из ЖКТ
- Распределение препарата в организме. Доставка препарата к месту действия
- Роль процесса связывания препарата белками плазмы в распределении препарата и достижении терапевтического эффекта
- Влияние патофизиологических факторов на процесс связывания препарата белками плазмы
- Кинетика метаболитов
Фармакокинетика. Основные понятия. Методы оценки основных ФК-показателей
- Модельный подход
- Однокамерная модель фармакокинетики
- Двухкамерная и многокамерные модели
- Нелинейные фармакокинетические модели
- Моделирование процесса связывания препарата белками плазмы
- Перфузионные модели
- Основные математические задачи ФК-моделирования и методы их решения
- Основные модельные методы оценки ФК-параметров
- Некомпартментный подход к анализу фармакокинетических данных
Основные принципы фармакодннамики
- Анализ зависимостей «концентрация—эффект» и «доза—эффект». ФК/ФД-модели
- Зависимость «доза—эффект» в случае переменных дихотомического типа
- Зависимость «концентрация—эффект» для переменных непрерывного типа
- Задачи, решаемые на основе ФД-моделирования
- Особенности ФД-моделирования эффекта антибактериальной, противоопухолевой и противосудорожной терапии
Популяционное моделирование
- Различные типы ФК/ФД-исследований
- Популяционная модель как способ хранения информации о поведении препарата у определенной группы пациентов и описания межиндивидуальной ФК-вариабельности
- Основные методы популяционного моделирования
- Сравнение возможностей параметрического
- и непараметрического подходов выявлять неоднородые популяции. Результаты реального исследования и вычислительного эксперимента
- Роль популяционного моделирования в решении задачи оптимизации дозирования
Терапевтический лекарственный мониторинг и индивидуализация фармакотерапии
- Оптимизация процедуры TЛM. Различные стратегии TЛM
- Некоторые общие вопросы фармакоэкономического обоснования применения процедуры ТЛМ и индивидуализации фармакотерапии в клинической практике
- Оптимальное дозирование лекарственных препаратов
- Постановка задачи
- Практические подходы к решению задачи оптимизации фармакотерапии
Приложения
- Некоторые модели печеночного клиренса
- Процедура оценки клиренса эндогенного креатинина
- Некоторые математические формы описания ФД-зависимостей
- Статистический анализ данных исследований биоэквивалентности
- Планирование исследований биоэквивалентности лекарственных препаратов
Список сокращенийЛитератураскачать книгу: «Прикладная фармакокинетика»
1.1. Виды физиологических рецепторов
Эффект
большинства лекарственных препаратов
является результатом их взаимодействия
с макромолекулярными компонентами
клеточных мембран. Это взаимодействие
вызывает биохимические и физиологические
изменения, характеризующие эффект
препарата.
Термин
рецептор применяется к клеточной
макромолекуле, с которой препарат
связывается для достижения его эффекта.
Протеины играют важнейшую роль в
формировании рецепторов
Наиболее
важной группой рецепторов для лекарств
являются протеины, физиологически
работают как рецепторы эндогенных
регуляторных лигандов (например,
рецепторы гормонов, нейротрансмиттеров).
Многие лекарства действуют на такие
рецепторы и часто являются высокоселективными
благодаря специфичности физиологических
рецепторов
Регуляторная
активность рецептора может проявляться
как следствие прямого действия на
клеточные мишени, эффекторные протеины,
или через промежуточные клеточные
сигнальные молекулы (трансдуктор).
Взаимодействие рецептора, клеточной
мишени и промежуточных молекул
рассматривают как рецептор-эффекторные
систему.
Рецепторы
связанные с G-протеином.
Большое семейство рецепторов для многих
существующих лекарств (биогенные амины,
эйкозаноиды, пептидные гормоны, опиоиды,
аминокислоты) включает гетеротримерные
регуляторные протеины, связанные с
гуанинтрифосфатом (G-протеины). G-протеины
являются сигнальными трансдукторами,
передающие информацию от рецепторов
эффекторным протеинам, таким как
аденилатциклаза, фосфолипаза С,
фосфодиэстеразы, Са2+
— и К+-ионные
каналы мембрани.
Рецепторы
для ферментов. Группа
рецепторов с внутренней ферментной
активностью включает протеинкиназы
клеточной поверхности, распространяющие
регуляторные сигналы через эффекторные
протеины на внутренней поверхности
клеточной мембраны. Фосфорилирование
протеинов может изменять биохимическую
активность эффектора, или его взаимодействие
с другими протеинами. Большинство
рецепторов, является протеинкиназами,
фосфорилируют тирозин в субстрате. Эта
группа включает рецепторы к инсулину,
факторам роста. Некоторые рецепторные
протеинкиназы фосфорилируют серин и
треонин.
Для
рецепторов, связывающих предсердный
натрийуретический пептид, гуанилин и
урогуанилин, внутриклеточной структурой
является гуанилилциклаза, а не
протеинкиназа. Гуанилилциклаза участвует
в секреции вторичного мессенжера
циклического гуанозинмонофосфата
(ГМФ), активирующего циклическую
ГМФ-зависимую протеинкиназу и активирует
несколько нуклеотидных фосфодиэстераз.
Ионные
каналы.
Рецепторы для некоторых нейротрансмиттеров
формируют селективные ионные каналы.
Эта группа включает никотиновые
холинергические рецепторы, рецепторы
ГАМК, рецепторы для глутамата, аспартата
и глицина.
Рецепторы
регулирующих транскрипцию. Рецепторы
для стероидных и тиреоидных гормонов,
витамина D, ретиноидов — это растворимые
протеины, которые связываются с ДНК и
регулируют транскрипцию специфических
генов.
Большинство
рецепторов в структуре имеют протеины,
их агрегаты и комплексы с нуклеиновыми
кислотами и низкомолекулярными
соединениями.
Биотрансформация лекарств. Несинтетические и синтетические реакции метаболизма.
Биотрансформацией
(метаболизмом) называют изменение
структуры лекарств в результате их
химической модификации. Основная
направленность процессов метаболизма
– перевод лекарств в гидрофильную
форму, которая лишена фармакологической
активности и способна легко выводиться
из организма.
Метаболизм лекарств включает 2 фазы:
I фаза –
несинтетические реакции метаболизма.К этой фазе относят окисление,
восстановление или гидролиз молекул
лекарства. Основная направленность
реакций этого типа – лишить ксенобиотик
активности.
Восстановление.Реакции
восстановления характерны для:
-
Кетонов,
альдегидов и карбоновых кислот. Эти
реакции протекают в печени. Таким
образом происходит, например,
восстановление варфарина. -
Нитроредукции ароматических соединений,
содержащих нитрогруппу. Данный вид
реакций протекает в печени и кишечнике.
Таким образом происходит метаболизм
метронидазола. R-NO2R-NH2 -
Азоредукция. Характерна для
салазопиридазина. R—N=N—R’R—NH2+H2N—R’
Гидролиз.Наиболее характерен
для сложных эфиров и замещенных амидов.
Протекает в стенке кишечника, печени и
крови. Функцию гидролиза эфиров в крови
чаще всего осуществляет фермент
псевдохолинэстераза (бутирилхолинэстераза),
который имеет низкую субстратную
специфичность и может гидролизовать
любую эфирную связь.
Путем гидролиза протекает метаболизм
эналаприла, тестостерона пропионата
(эфирный гидролиз), лидокаина (амидный
гидролиз).
Окисление.Окисление биологических
субстратов – универсальный механизм
инактивации ксенобиотиков, который
обеспечивают микросомальные ферменты
печени. Это группа липофильных белков,
сосредоточенная в мембранах
эндоплазматического ретикулума
гепатоцитов. Основой микросомальной
системы ферментов являются 2 энзима:
флавопротеин-НАДФ·Н-зависимая цитохром
Р450редуктаза и гемопротеин
цитохром Р450.
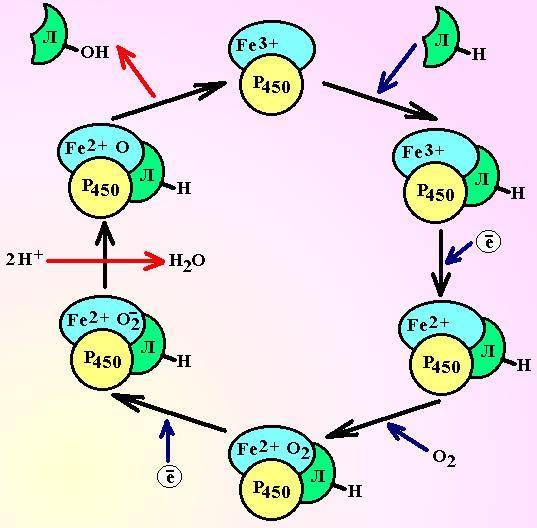
Схема 6. Цикл
микросомального окисления.
Пояснения в тексте. Л – лекарственное
вещество.
Первоначально, окисленный Р450присоединяет лекарственное вещество.
Затем, комплекс цитохром-лекарство
восстанавливается НАДФ·Н-зависимой
редуктазой и присоединяет кислород.
Для активации молекулы кислорода
НАДФ·Н-зависимая редуктаза повторяет
цикл восстановления. На финальном этапе,
один из атомов кислорода включается в
молекулу воды, а второй – в лекарственное
вещество, после чего цитохром регенерирует
в исходное состояние.
Цитохром Р450является не 1 ферментом,
а суперсемейством из более чем 300 изоформ,
способных катализировать около 60 типов
окислительных реакций, с сотнями
потенциальных субстратов. Фактически,
цитохромы способны обеспечить окисление
не только всех существующих в настоящее
время молекул лекарств, но и все лекарства,
которые когда-либо еще будут синтезированы.
Молекулы цитохрома Р450, которые
функционируют в клетках человека могут
быть объединены в 17 семейств:CYP1-CYP17.
Наибольшую роль в метаболизме лекарств
играют первые 3 семействаCYP1-CYP3
(из них изоформыCYP3A4/3A5
иCYP2D6
метаболизируют 75% всех лекарств).
II фаза –
синтетические реакции метаболизма.Как правило, эти реакции протекают
только после того, как завершиться фазаI. Синтетические реакции
метаболизма призваны повысить
гидрофильность ксенобиотика. Все реакции
этой группы могут быть разделены на 2
вида:
Реакции, в которых активируется
конъюгирующее вещество:
-
Глюкуронизация;
-
Ацетилирование;
-
Сульфатирование;
-
Метилирование.
Реакции, в которых активируется
ксенобиотик:
Глицилирование.
Основной
реакцией конъюгации в организме взрослого
человека является глюкуронизация.
Значение фармакокинетики для лекарственной терапии.
В настоящее время ни одно информационное
сообщение о лекарственных средств (ЛС)
в справочниках, проспектах или упаковочных
листах-вкладышах не обходится без
подробного описания их фармакодинамики
и фармакокинетики
Если вопросы
фармакодинамики ЛС и ранее находили
свое отражение через призму их показаний
и противопоказаний к назначению, то
фармакокинетике препаратов уделялось
весьма скромное внимание, а для многих
ЛС данные по фармакокинетике и вовсе
отсутствовали
Положение резко
изменилось после «талидомидовой»
трагедии, послужившей своеобразным
импульсом бурного развития в 60-х годах
нашего столетия клинической фармакологии
(КФ) — науки, занимающейся изучением ЛС
в применении к человеку. Пристальный
интерес врачей во всем мире к КФ и ее
составной части — клинической
фармакокинетике — был вызван надеждой
клиницистов на то, что с помощью этого
направления можно будет создать глубоко
научные и объективные основы эффективного
и безопасного применения ЛС.
Термин
«фармакокинетика» впервые был предложен
в 1953 году Ф. Достом, а в 1974 году во введении
к сборнику материалов первого симпозиума
по клинической фармакокинетике было
дано простое и ясное с точки зрения КФ
и практической медицины определение
этой дисциплине: «Клиническая
фармакокинетика — это отрасль науки о
здоровье, которая использует
фармакокинетические подходы для
безопасного и эффективного терапевтического
применения лекарств у конкретных
больных».
Как раздел
общей фармакологиии, фармакокинетика
представляет собой науку, изучающую
поведение ЛС в живом организме на этапах
всасывания, распределения, метаболизма
и экскреции. Еще точнее определили эту
дисциплину болгарский фармаколог В.
Петков, который сказал, что «фармакокинетика
изучает все то, что делает организм с
лекарственным веществом». Это тем более
верно, что организм при попадании в него
чужеродных соединений, к которым
относятся и ЛС, стремится создать условия
для их скорейшей элиминации. Именно эти
условия, как звенья гомеостатической
реакции очень часто и лежат в основе
поведения ЛС в организме, что может
сопровождаться или снижением клинической
эффективности применяемых лекарств
или появлением весьма нежелательных
последствий в виде побочных и токсических
реакций.
Современная
клиническая фармакокинетика, опираясь
на данное мировозрение, внесла и
продолжает вносить большой вклад в
создание науки о том, как лечить
лекарствами с учетом особенностей самих
ЛС и ответной реакции организма на их
введение. Общепринято, что создание
новых ЛС предполагает обязательное
проведение фармакокинетических
исследований, а каждое лекарство должно
иметь свой «фармакокинетический
паспорт». Все это подчинено главной
задаче — использованию параметров
фармакокинетики для оптимизации и
индивидуализации применения ЛС, что и
составляет основу рациональной
фармакотерапии (ФТ).
Уровень и
объем знаний по фармакокинетике ЛС за
последние десятилетия значительно
возросли. Это привело к появлению в
фармакотерапевтическом обиходе большого
количество параметров и показателей,
характеризующих фармакокинетику
лекарственных препаратов. К сожалению,
в реальных клинических условиях не все
они и, тем более в полной мере, востребованы
и используются. Это связано, во-первых,
с недостатками по аппаратному обеспечению
их повседневного и повсеместного
анализа, а, во-вторых, с наличием
затруднений у практических врачей по
клинической интерпретации справочных
параметров фармакокинетики ЛС для
построения рациональных схем и режимов
фармакологической коррекции.
В современной
ФТ идет процесс устранения указанных
недостатков, но, поскольку недостатки
первого типа в наших условиях в силу
проблем экономического характера
устранить пока трудно, то большее
внимание следует уделять недостатками
второго типа, что имеет не меньшее
значение для оптимизации фармакологического
лечения
Биотрансформация лекарственных средств
Биотрансформация представляет собой
метаболические превращения
лекарственных средств. В большинстве
реакций образуются метаболиты, более
полярные, чем исходные лекарственные
средства. Полярные метаболиты хуже
растворяются в липидах, но обладают
высокой растворимостью в воде, меньше
подвергаются энтерогепатической
циркуляции (выведение с желчью в кишечник
и повторное всасывание в кровь) и
реабсорбции в почечных канальцах. Без
биотрансформации одна терапевтическая
доза снотворного средства этаминала
могла бы находиться в организме
100 лет.
Эндобиотики подвергаются превращениям
под влиянием специфических ферментов,
осуществляющих метаболизм их эндогенных
аналогов. Ксенобиотики используют
для метаболизма ферменты с малой
субстратной специфичностью, например,
окисляются при участии ци-тохрома Р-450,
созданного в эволюции 3,5
миллиарда лет тому назад для инактивации
стероидов.
Биотрансформация ксенобиотиков
происходит в печени (90-95%),
слизистой оболочке тонкого кишечника,
почках, легких, коже, крови. Наиболее
изучены процессы биотрансформации на
мембранах гладкого эндоплазматического
ретикулума (ЭПР) печени. При гомогенизации
и ультрацентрифугировании клеток
канальцы ЭПР разрываются и превращаются
в функционально активные фрагменты
— микросомы. Реакции биотрансформации
протекают также в ядре, цитозоле,
митохондриях, плазматической мембране.
Процессы биотрансформации разделяют
на 2 фазы. В реакциях первой
фазы — метаболической
трансформации молекулы лекарственных
средств подвергаются окислению,
восстановлению или гидролизу.
Большинство лекарств преобразуется в
неактивные метаболиты, но также могут
появляться активные и токсические
производные (табл. 3.1). Во
второй фазе — реакциях
конъюгации лекарственные средства
присоединяют ковалентной связью полярные
фрагменты с образованием неактивных
продуктов. Для реакций конъюгации
необходима затрата энергии.
Таблица 3.1
Активные метаболиты лекарственных
средств
|
Лекарственное |
Активный |
|
Амитриптилин |
Нортриптилин |
|
Анаприлин |
Гидроксипропраналол |
|
Бутадион |
Оксифенилбутазон |
|
Дигитоксин |
Дигоксин |
|
Имипрамин |
Дезипрамин |
|
Кислота |
Кислота |
|
Кодеин |
Морфин |
|
Кортизон |
Гидрокортизон |
|
Метилдопа |
Метилнорадерналин |
|
Новокаинамид |
N-ацетилновокаинамид |
|
Сибазон |
Нордазепам, |
|
Спиронолактон |
Канренон |
|
Теофиллин |
Кофеин |
|
Хлозепид |
Деметилзлордиазепоксид, |
Виды доз.
Пороговая – Среднетерапевтическая Высшая терапевтическая Широта терапевтического действия Токсическая Смертельная Разовая Курсовая Ударная Поддерживающая
Действие лекарств при их повторном введении в организм.
Кумуляция (КумуляцияМатериальная кумуляция Функциональная кумуляция Привыкание
Перекрестное привыкание Фармакокинетика –
Пути введения ЛС в организм.
От пути введения препарата в организм зависит:
- скорость и полнота доставки ЛС в очаг болезни;
- эффективность и безопасность применения лекарств, т.е. без осложнений фармакотерапии.
- Энтеральный путь введения – путь поступления лекарств в организм через ЖКТ. К достоинствам энтерального пути введения:
- удобство применения;
- безопасность применения;
-
проявление местного и резорбтивного эффектов. К энтеральному пути относится:
- пероральный (per os) – через рот (внутрижелудочно);
- сублингвальный (Sub linqva) – под язык;
- интрадуоденальный (Intra duodenum) – в 12-перстную кишку.
- ректальный (per rectum) – через прямую кишку.
- Парентеральный путь введения – это поступление ЛС в организм, минуя органы ЖКТ. К достоинствам парентерального пути относятся:
- достижение точной дозировки;
- быстрая реализация эффекта ЛС. К парентеральному пути относится:
- внутривенное введение;
- внутриартериальное введение;
- внутримышечное введение;
- подкожное введение;
- интратрахеальное введение;
- интравагинальное введение;
- внутрикостное введение.
Характеристика отдельных этапов фармакокинетики.
- Всасывание (абсорбция) — процесс поступления лекарства из места его введения в системный кровоток при внесосудистом введении.
Скорость всасывания ЛС зависит от:
- лекарственной формы препарата;
- степени растворимости ЛС в жирах или в воде;
- дозы или концентрации ЛС;
- пути введения;
- интенсивности кровоснабжения органов и тканей.
Скорость всасывания при пероральном применении ЛС зависит от:
- рН среды в различных отделах ЖКТ;
- характера и объема содержимого желудка;
- микробной обсемененности кишок;
- активности пищевых ферментов;
- состояния моторики ЖКТ;
- интервала между приемом лекарства и пищи.
Процесс всасывания ЛС характеризуется следующими фармакокинетическими параметрами:
- Биодоступность (f) – относительное количество препарата, которое поступает из места введения в кровь (%).
- Константа скорости всасывания (К01) – параметр, который характеризует скорость поступления ЛС из места введения в кровь (ч -1, мин -1).
- Период полуабсорбции (t½α) – время, необходимое для всасывания из места введения в кровь ½ введенной дозы (ч, мин).
- Время достижения максимальной концентрации (tmax) – это время, за которое достигается максимальная концентрация ЛС в крови (ч, мин).
- Биотранспорт – обратимые взаимодействия ЛВ с транспортными белками плазмы крови и мембранами эритроцитов. Подавляющее число лекарства (90%) обратимо взаимодействуют с человеческим сывороточным альбумином. Кроме того,
= .Связанная часть ЛС с транспортным белком определяет:
- силу фармакологического действия лекарства;
- продолжительность фармакотерапевтическогоего действия. Места связывания белка являются общими для многих веществ.
- Константа ассоциации (Касс) – характеризует степень сродства препарата к белку сыворотки крови (моль-1).
- Число мест связывание (N) – показатель активных центров белка, на которых фиксируется одна молекула препарата.
3. Распределение лекарств в организме.
- степень растворимости в липидах;
- интенсивность регионарного (местного) кровоснабжения;
- степень сродства к транспортным белкам;
- состояние биологических барьеров (гематоэнцефалического, плацентарного). Основными местами распределения ЛС в организме являются:
- внеклеточная жидкость;
- внутриклеточная жидкость;
- жировая ткань.
Фрмакокинетический параметр, характеризующий этап распределения:Объем распределения (Vd)
4. Биотрансформация (метаболизм).
Биотрансформация осуществляется в 2 фазы.Реакции I фазы (биотрансформации) реакций II фазы
5. Выведение (экскреция).
- клубочковая фильтрация;
- канальцевая секреция;
- канальцевая реабсорбция.
Основные фармакокинетические параметры:
- Константа экскреции (Кех) – характеризует скорость выделения лекарства из организма с каким-либо экскретом (ч-1, мин-1).
- Константа элиминации (Кel) – характеризует скорость исчезновения препарата из организма путем экскреции и биотрансформации (ч-1,мин-1).
- Период полуэлиминации (t1/2) – это время исчезновения из организма лекарства путем биотрансформации и экскреции ½ введенной или поступившей и всосавшейся дозы (ч, мин.).
Источники и этапы создания лекарств. Определение понятий лекарственное вещество, лекарственное средство, лекарственный препарат и лекарственная форма. Название лекарств.
Источники
создания ЛС:
а)
натуральное сырье: растения, животные,
минералы и т.д. {сердечные гликозиды,
свиной инсулин}
б)
модифицированные природные БАВ
в)
синтетические соединения
г)
продукты генной инженерии {рекомбинантный
инсулин, интерфероны}
Этапы
создания ЛС:
1.
Синтез ЛС в химической лаборатории
2.
Доклиническая оценка активности и
нежелательных эффектов ЛС Минздравов
и др. организмациями
3.
Клинические испытания ЛС (подробнее
см. в. 1)
Лекарственное
средство – любое
вещество или продукт, используемые,
чтобы модифицировать или исследовать
физиологические системы или патологические
состояния для блага реципиента (по ВОЗ,
1966 г.); индивидуальные вещества, смеси
веществ или композиции неизвестного
состава, обладающие доказанными лечебными
свойствами.
Лекарственное
вещество –
индивидуальное химическое соединение,
используемое в качестве лекарственного
средства.
Лекарственная
форма – удобная
для практического применения форма,
придаваемая лекарственному средству
для получения необходимого лечебного
или профилактического эффекта.
Лекарственный
препарат –
лекарственное средство в определенной
лекарственной форме, разрешенное органом
государственного управления.
Список источников
- StudFiles.net
- idatenru.ru
- xreferat.com
- www.booksmed.com
